【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:
(1)配平上述反应的化学方程式: ___ Na + _____CO2![]() _____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
_____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
(2)CO2的电子式为:_________________,Na原子核外电子有_______个能级。
(3)已知:
常压下 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
若反应在常压、890℃下进行,写出该反应的平衡常数表达式______________________。若3v正(Na)=4v逆(CO2),则________(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(4)副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因:______________________________________________________________________________________。若在10升容器中,反应进行了5min, 金刚石的质量增加了6g,则5min里CO2的平均反应速率 为______________。
【题目】氮的氧化物![]() 如
如![]() 、
、![]() 、
、![]() 等
等![]() 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
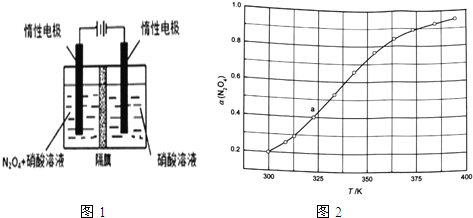
(1)从![]() 可通过电解或臭氧氧化
可通过电解或臭氧氧化![]() 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示![]() 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过![]() ,其阳极反应式为______.
,其阳极反应式为______.
已知:![]()
![]()
![]()
则反应![]() 的
的![]() ______.
______.
(2)从![]() 在一定条件下发生分解:
在一定条件下发生分解:![]() 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中![]() 浓度随时间的变化如下表:
浓度随时间的变化如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
设反应开始时体系压强为![]() ,第
,第![]() 时体系压强为p,则p:
时体系压强为p,则p:![]() ______;
______;![]() 内,
内,![]() 的平均反应速率为______.
的平均反应速率为______.
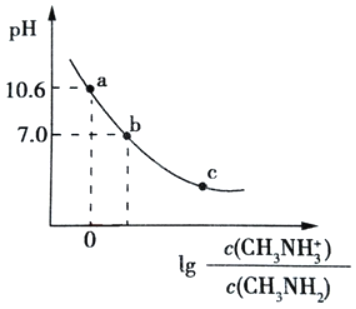
(3)从![]() 与
与![]() 之间存在反应
之间存在反应![]() 将一定量的
将一定量的![]() 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率![]() 随温度变化如图1所示.
随温度变化如图1所示.
![]() 图中a点对应温度下,已知
图中a点对应温度下,已知![]() 的起始压强
的起始压强![]() 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数![]() ______
______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() .
.
![]() 由图推测
由图推测![]() 是吸热反应还是放热反应,说明理由______,若要提高
是吸热反应还是放热反应,说明理由______,若要提高![]() 转化率,除改变反应温度外,其他措施有______
转化率,除改变反应温度外,其他措施有______![]() 要求写出两条
要求写出两条![]() .
.
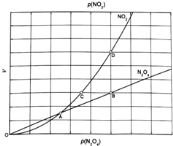
![]() 对于反应
对于反应![]() ,在一定条件下
,在一定条件下![]() 与
与![]() 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系:![]() ,
,![]() 其中,
其中,![]() 、
、![]() 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,![]() 、
、![]() 与平衡常数
与平衡常数![]() 的关系是
的关系是![]() ______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.