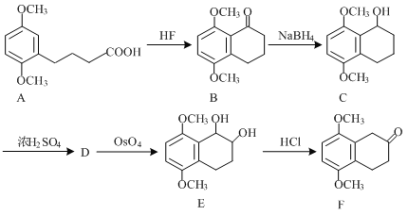
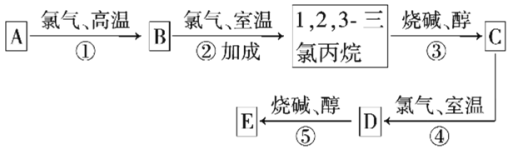
��Ŀ����
����Ŀ���й���ѧ���ý����ƺ�CO2��һ���������Ƶ��˽��ʯ��
��1����ƽ������Ӧ�Ļ�ѧ����ʽ�� ___ Na + _____CO2![]() _____Na2CO3 + _____C(���ʯ)������Ӧ��������0.15mol CO2��Ӧ�������ת�Ƶ���ĿΪ��____________��
_____Na2CO3 + _____C(���ʯ)������Ӧ��������0.15mol CO2��Ӧ�������ת�Ƶ���ĿΪ��____________��
��2��CO2�ĵ���ʽΪ��_________________��Naԭ�Ӻ��������_______���ܼ���
��3����֪��
��ѹ�� | �� | Na2CO3 | ���ʯ | ʯī |
�۵㣨���� | 97.8 | 851 | 3550 | 3850 |
�е㣨���� | 882.9 | 1850���ֽ����CO2�� | ---- | 4250 |
����Ӧ�ڳ�ѹ��890���½��У�д���÷�Ӧ��ƽ�ⳣ������ʽ______________________����3v��(Na)=4v��(CO2)����________��ѡ����ţ���
a����Ӧ�϶��ﵽƽ�� b����Ӧ���ܴﵽƽ�� c����Ӧ�϶�δ��ƽ��
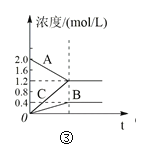
��4��������Na2CO3����ˮ����Һ�ʼ��ԣ�����ƽ���ƶ���ԭ��������������������Һ�ʼ��Ե�ԭ��______________________________________________________________________________________������10�������У���Ӧ������5min, ���ʯ������������6g����5min��CO2��ƽ����Ӧ���� Ϊ______________��
���𰸡�4 3 2 1 0.2NA ![]() 4 K=
4 K=![]() a ����̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȡ� 0.03 mol/(L��min)
a ����̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȡ� 0.03 mol/(L��min)
��������
��1�����ݵ����غ��������������ת�Ƶ�����Ŀ��
��2��������̼�ĵ���ʽΪ![]() ��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1��
��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1��
��3������һЩ���ʵ��۷е����ݣ��ڳ�ѹ��890��ʱNa��CO2������̬��Na2CO3��C��������̬����ɵø÷�Ӧ��ƽ�ⳣ������ʽ������һ��һ�棬����֮�ȵ���ϵ���ȣ���Ӧ�϶��ﵽƽ�⣻
��4��Na2CO3����ˮ����Һ�ʼ�������Ϊ̼�������ˮ�⣻CO2��ƽ����Ӧ����=![]() ��
��
��1����Ӧ����Ԫ�ش�0�����ߵ�+1�ۣ�����1�ۣ�̼Ԫ�ش�+4�۽��͵�0�ۣ�����4�ۣ���˵������뵥��̼�ļ�����֮��Ϊ4:1���ٸ���Ԫ���غ���ƽ�������ʵļ���������ƽ��ķ���ʽΪ4Na+3CO22Na2CO3+C����3mol CO2��Ӧʱ��ת��4mol���ӣ�����0.15mol CO2��Ӧʱ��ת�Ƶ���0.2mol���ʴ�Ϊ��4��3��2��1��0.2NA��
��2��������̼�ĽṹʽΪO=C=O��C��O֮��������Ե��Ӷԣ��ʵ���ʽΪ![]() ��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1����4���ܼ����ʴ�Ϊ
��Naԭ�Ӻ�������Ų�ʽΪ1s22s22p63s1����4���ܼ����ʴ�Ϊ![]() ��4��
��4��
��3�����ݱ���һЩ���ʵ��۷е����ݣ���֪�ڳ�ѹ��890��ʱNa��CO2������̬��Na2CO3��C��������̬����÷�Ӧ��ƽ�ⳣ������ʽ ![]() ����3v����Na��=4v����CO2��������һ��һ�棬����֮�ȵ���ϵ���ȣ���Ӧ�϶��ﵽƽ�⣬�ʴ�Ϊ��K=
����3v����Na��=4v����CO2��������һ��һ�棬����֮�ȵ���ϵ���ȣ���Ӧ�϶��ﵽƽ�⣬�ʴ�Ϊ��K=![]() ��a��
��a��
��4��Na2CO3����ˮ��̼�������ˮ�⣬Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȣ�������Ӧ��10L�ܱ���������ѹ�½��У�5min�ڣ���ý��ʯ������������6g����Ӧ�Ķ�����̼���ʵ�����ϻ�ѧ����ʽ����õ���4Na+3CO22Na2CO3+C�����ʯ�����������ʵ���1.5mol����Ӧ����v��CO2��=![]() =
=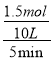 =0.03mol/��Lmin�����ʴ�Ϊ������̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȣ� 0.03 mol/(L��min)��
=0.03mol/��Lmin�����ʴ�Ϊ������̼����������ʣ�Na2CO3����ˮ��������̼������ӽ����ˮ������������ӣ�����ˮ�ĵ���ƽ�⳯����Ӧ�����ƶ�������������Ũ�ȴ���������Ũ�ȣ� 0.03 mol/(L��min)��

����Ŀ��A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�����������(ÿ������ֻ��һ���������һ����ظ�)��
������ | Na����Ba2����NH4+ |
������ | CH3COO����Cl����OH����SO42- |
��֪����A��C��Һ��pH������7����ͬŨ��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ����������
��1��A��___��B��___��
��2��д��C��D��Ӧ�����ӷ���ʽ___��
��3��25��ʱ��0.1mol��L��1B��Һ��pH��a����B��Һ��c(H��)��c(NH3��H2O)��___(�ú���a�Ĺ�ϵʽ��ʾ)��
��4����������������ʵ���Ũ�ȵ�B��Һ��C��Һ��ϣ���Ӧ����Һ�и�������Ũ���ɴ�С��˳��Ϊ___��
��5����һ�������0.005mol��L��1��C��Һ�У�����һ�������0.00125mol��L��1������ʱ�������Һ��pH��11������Ӧ����Һ���������C��Һ����������֮�ͣ���C��Һ��������������___��