题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.1mol CH3COONa与少量CH3COOH溶于水所得的中性溶液中,CH3COO﹣数目为NA
B.标准状况下,2.24 L甲醇中C﹣H键的数目为0.3NA
C.4.6gNa与100mL1.0mol/L的盐酸溶液反应,转移电子数目为0.2NA
D.NA个D2 16O分子中含有10NA个中子
【答案】B
【解析】
A.溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),该溶液显中性,则c(H+)=c(OH﹣),故c(Na+)=c(CH3COO﹣),n(Na+)=n(CH3COO﹣)=1 mol,即CH3COO﹣数目为NA,故A正确;
B.标准状况下,2.24 L甲醇不是气体,不能计算物质的量,故B错误;
C.依据n=![]() 计算物质的量=
计算物质的量=![]() =0.2mol,钠在盐酸溶液中全部反应,Na由0价变为+1价,1mol钠转移1mol电子,4.6gNa为0.2mol,电子转移数目为0.2NA,故C正确;
=0.2mol,钠在盐酸溶液中全部反应,Na由0价变为+1价,1mol钠转移1mol电子,4.6gNa为0.2mol,电子转移数目为0.2NA,故C正确;
D.NA个D216O分子物质的量为1mol,1molD216O 分子中中子数为:[(2﹣1)×2+16﹣8]×NA=10NA,故D正确;
答案选B。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
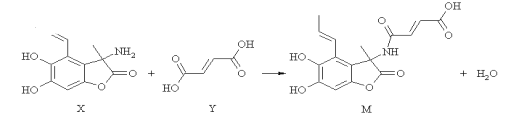
英才计划期末调研系列答案【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:
(1)配平上述反应的化学方程式: ___ Na + _____CO2![]() _____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
_____Na2CO3 + _____C(金刚石)。若反应过程中有0.15mol CO2反应,则电子转移的数目为:____________。
(2)CO2的电子式为:_________________,Na原子核外电子有_______个能级。
(3)已知:
常压下 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
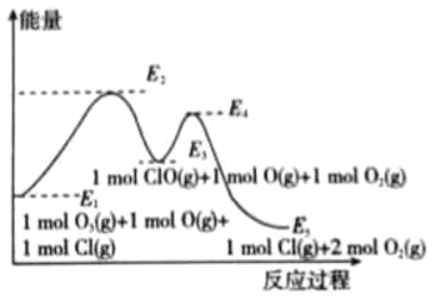
若反应在常压、890℃下进行,写出该反应的平衡常数表达式______________________。若3v正(Na)=4v逆(CO2),则________(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(4)副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因:______________________________________________________________________________________。若在10升容器中,反应进行了5min, 金刚石的质量增加了6g,则5min里CO2的平均反应速率 为______________。
【题目】(1)计算调控值:
室温下,当溶液中c(Mg2+)=c(Cu2+)=0.1mol·L-1时,Mg2+、Cu2+开始沉淀至沉淀完全的pH范围分别为__。已知:Ksp[Mg(OH)2]=10-9、Ksp[Cu(OH)2]=10-15,当c(Mg2+)≤1×10-5mol·L-1时视为沉淀完全。
(2)选择调控值
铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
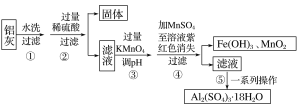
已知步骤③中所得溶液生成氢氧化物沉淀的pH如表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时的pH | 3.4 | 6.3 | 1.5 |
完全沉淀时的pH | 4.7 | 8.3 | 2.8 |
在该浓度下除去铁的化合物,调节pH的最大范围为___。
(3)如何调控
接问题(2),步骤③中调pH时最佳试剂为___。
(4)突破应用
为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。
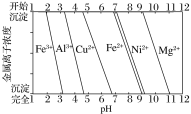
结合题图信息推断该合金中除铜外一定含有__。