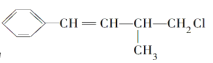【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的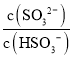 =___________
=___________
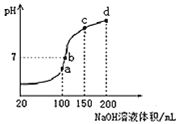
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
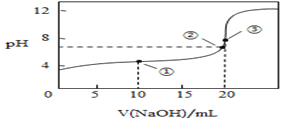
①在滴定的实验过程中,不需要的仪器或用品是________(填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是 _________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________c(CH3COOH)+c(H+)(填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______/span>mol/L,此时溶液中c(CrO42-)等于_________mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)