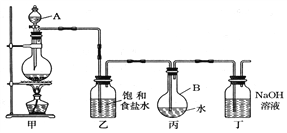
题目内容
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )
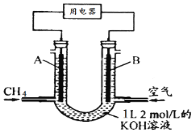
A.OH-由A端移向B端
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4 + 2O2 + KOH = KHCO3 + 2H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4 - 8e- + 9CO32- + 3H2O = 10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-)
【答案】C
【解析】
试题分析:A、燃料电池中,通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极,在原电池中阴离子向负极移动,OH-由B端移向A端,故A错误;B、当0<V≤22.4L时,0<n(CH4)≤1mol,则0<n(CO2)≤1mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,故B错误;C、当22.4 L<V≤44.8L,1mol<n(CH4)≤2mol,则1mol<n(CO2)≤2mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故C正确;D、当V=33.6L时,n(CH4)=1.5mol,n(CO2)=1.5mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到0.5molK2CO3和1molKHCO3的溶液,则c(HCO3-)>c(CO32-)>c(OH-),故D错误;故选C。

【题目】下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A-E中选择各题要求的序号填入表中
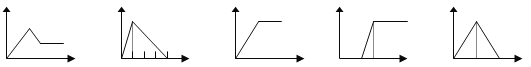
A B C D E
溶液 | 加入的物质 | 答案序号 |
饱和石灰水 | 通CO2至过量 | _____ |
AlCl3溶液 | 通过量的NH3 | _____ |
含少量NaOH的NaAlO2溶液 | 通过量的CO2 | _____ |
NaAlO2溶液 | 滴加稀HCl至过量 | _____ |
MgCl2 AlCl3的混和液 | 滴加NaOH至过量 | _____ |