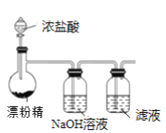
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO | 正确;Mg(OH)2比MgCO3更难溶 |
C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO | 正确;H2SO3的酸性强于HClO |
D | 将Na2O2固体溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑ | 正确; Na2O2是碱性氧化物 |
A.AB.BC.CD.D
【题目】工业上用铝土矿(主要成分为Al2O3,含有少量SiO2、FeO·xFe2O3等杂质)制取铝的一种工艺流程示意图如下:
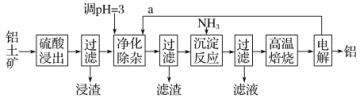
已知:生成氢氧化物沉淀的pH如下表。
沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH | 3.2 | 5.2 | 12.4 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_______________
(2)浸渣的主要成分为____________________
(3)净化除杂操作分为两步:第一步是通入气体a,其目的是_____________________。第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化除杂生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________
(4)写出沉淀反应操作中发生反应的离子方程式:________________________。
(5)实验室高温焙烧时,用于盛放固体的仪器名称是_______________。
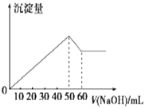
(6)在AlCl3和MgCl2的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原溶液中AlCl3和MgCl2的物质的量之比为__________,并写出加入NaOH溶液的体积为50-60mL时的化学反应方程式__________________________。