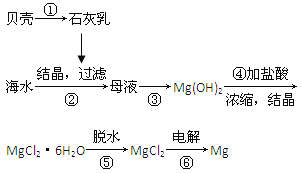
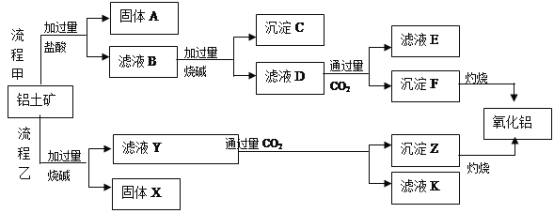
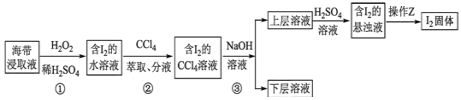
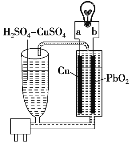
题目内容
【题目】实验室欲配制0.1 mol/L的NaOH溶液450 ml,下列说法正确的是( )
A.用托盘天平称量固体的质量为1.8 g
B.称量NaOH固体时可在烧杯中进行
C.定容时仰视读数所得溶液的浓度偏大
D.当液面在刻度线下2-3 mm时,换用胶头滴管滴加蒸馏水定容
【答案】B
【解析】
A.实验室没有规格是450 mL的容量瓶,要使用500 mL的容量瓶配制溶液,则需NaOH的物质的量为n(NaOH)=c·V=0.1 mol/L×0.5 L=0.05 mol,则需称量NaOH的质量m(NaOH)=n·M=0.05 mol×40 g/mol=2.0 g,A错误;
B.NaOH具有吸湿性、腐蚀性,所以称量NaOH固体时可在烧杯中进行,B正确;
C.定容时仰视读数,则溶液的体积偏大,根据c=![]() 可知:V偏大,则所得溶液的浓度偏小,C错误;
可知:V偏大,则所得溶液的浓度偏小,C错误;
D.当液面在刻度线下1~2 cm时,换用胶头滴管滴加蒸馏水定容,D错误;
故合理选项是B。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4。其反应的离子方程式:Fe(OH)3+ClO-+OH-→FeO42-+H2O+Cl-(未配平)。配平上述离子方程式,用单线桥法标出电子转移方向和数目。___
___Fe(OH)3+___ClO-+___OH-→___FeO42-+___H2O+___Cl-
该反应中,还原剂是___,被还原的元素是___。
(2)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)+Q。
2Fe(s)+3CO2(g)+Q。
已知该反应在不同温度下的平衡常数如表。
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式为___,Q__0(填“>”、“<”或“=”)。
(3)在容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速率v(CO2)=___,CO的平衡转化率为____。
(4)欲提高CO的平衡转化率,可采取的措施是___。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
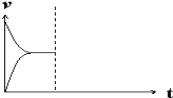
(5)现在恒压密闭容器中通入1molH2和1molCO2发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。___
CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。___
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
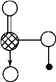
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。