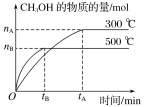
题目内容
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO | 正确;Mg(OH)2比MgCO3更难溶 |
C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO | 正确;H2SO3的酸性强于HClO |
D | 将Na2O2固体溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑ | 正确; Na2O2是碱性氧化物 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 将2 mol Cl2通入到含1 mol FeI2的溶液中,亚铁离子和碘离子全部被氧化:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2,离子方程式书写错误,与题意不符,A错误;
B. 离子方程式正确,Mg(OH)2比MgCO3更难溶,符合题意,B正确;
C. 次氯酸根离子具有强氧化性,能够把二氧化硫氧化为硫酸根离子,所以过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=2H++Cl-+SO42-,离子方程式书写错误,与题意不符,C错误;
D. Na2O2是过氧化物,不属于碱性氧化物,与题意不符,D错误;
答案为B。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
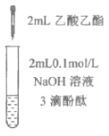
百分学生作业本题练王系列答案【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
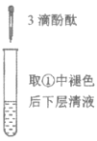
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
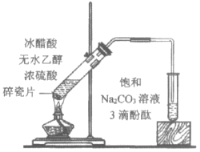
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸