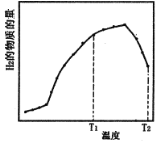
【题目】(1)下列3种不同粒子![]() H、
H、![]() H、
H、![]() H表示______种元素,______种核素,
H表示______种元素,______种核素,![]() H、
H、![]() H、
H、![]() H互称为__________________。
H互称为__________________。
(2)有人称煤炭是“工业的粮食”,通过煤的综合利用可以获得重要化工原料,如焦炭,它是煤的______ (填“蒸馏”或“干馏”)产物,可用于________________ (填出一种用途);以煤为原料可以制得水煤气,其反应的化学方程式为________________________________。
(3)元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
元素 | Al | B | Be | C | Cl | X | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Y | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
①根据上表给出的数据,可知元素的电负性越大,____________(填“金属性”或“非金属性”)越强。
②推测Y 为______(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程__________________。