【题目】我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
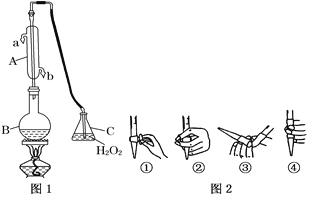
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
A.c(Na+)=c(HSO3-)+2c(SO32-) |
B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |
【题目】下表为几种短周期元素的性质:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 66 | 160 | 152 | 110 | 99 | 186 | 70 | 88 |
最高化合价 |
|
|
|
|
|
|
| |
最低化合价 |
|
|
|
|
下列有关上述元素的说法正确的是
A.元素⑤的氢化物的沸点高于元素①的氢化物的沸点
B.②⑦形成的化合物为共价化合物
C.上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤
D.元素⑧位于周期表中第3周期ⅢA族
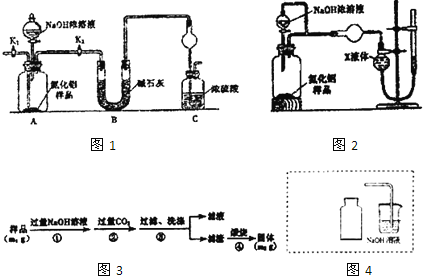
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
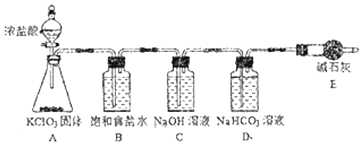
(1)该小组按如图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表。(已知饱和NaClO溶液pH为11)
实验步骤 | 实验现象 | ||
B瓶 | C瓶 | D瓶 | |
实验1:取样,滴加紫色石蕊溶液 | 变红,缓慢褪色 | 变红,缓慢褪色 | 立即褪色 |
实验2:取样,测定溶液的pH | 3 | 12 | 7 |
①装置A中反应的化学方程式为____。
②B瓶溶液中H+的主要来源是____。
③C瓶溶液的溶质是___(填化学式)。
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因____。
(2)测定C瓶溶液中NaClO含量(单位:gL-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000molL-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
①NaClO的电子式为____。
②步骤Ⅰ总反应的离子方程式为____。
③C瓶溶液中NaClO的含量为____gL-1。(保留1位小数,NaClO式量为74.5)
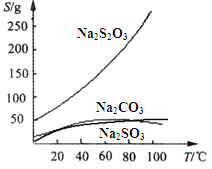
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S = Na2S2O3 。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。
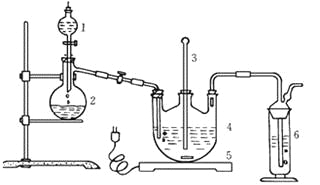
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为______________,装置6中可放入___________。
A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
![]()
(3)为减少产品的损失,操作①为__________,操作②是过滤洗涤干燥,其中洗涤操作是用________(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于__________(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:_____________________。
③产品中Na2S2O3·5H2O的质量分数为______________。