题目内容
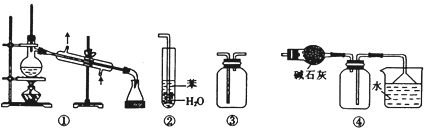
【题目】我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
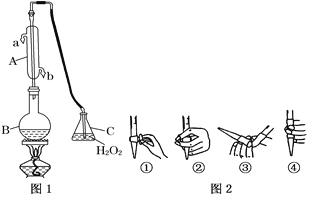
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
A.c(Na+)=c(HSO3-)+2c(SO32-) |
B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |
【答案】直形冷凝管 b SO2+H2O2=H2SO4 ③ 酚酞 ④ 0.24 原因:盐酸的挥发; 改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响 AD
【解析】
测定葡萄酒中二氧化硫的含量,首先把葡萄酒和适量盐酸放入B中,加热使二氧化硫全部逸出进入H2O2中被吸收,生成硫酸(H2O2+SO2=H2SO4),然后用中和滴定的方法测定硫酸的浓度,进而计算二氧化硫的含量。盐酸的作用是促使二氧化硫逸出,但盐酸本身也有挥发性,对中和滴定结果有影响,所以应把盐酸换成硫酸。
(1)根据仪器A的构造可知,仪器A为直形冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0);若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以④正确;
(4)根据2NaOH~H2SO4~SO2可知SO2的质量为:![]() ×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:
×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:![]() =0.24g/L;
=0.24g/L;
(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响;
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,c(H+)=c(OH-),依据溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),得到c(Na+)=c(HSO3-)+2c(SO32-),A正确;若c(HSO3-)=c(SO32-),溶液呈碱性c(H+)<c(OH-),故B错误;由物料守恒可知亚硫酸氢钠和亚硫酸钠按照1:1混合,溶液呈碱性,溶液中物料守恒为:2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-),但由于溶液呈中性,亚硫酸氢钠和亚硫酸钠的物质的量不同,故C错误;依据化学式可知,亚硫酸氢钠中硫元素物质的量和钠元素的物质的量相同,亚硫酸钠中钠元素的物质的量大于亚硫酸根中硫元素的物质的量,所以c(Na+)>c(HSO3-)+c(SO32-)+c(H2SO3),故D正确。

 阅读快车系列答案
阅读快车系列答案