题目内容
【题目】Y 是一种天然除草剂,其结构如图所示,下列说法正确的是( )
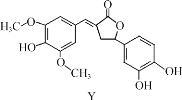
A.Y 可以和NaHCO3 溶液发生反应
B.Y 分子中所有碳原子一定在同一平面内
C.1 mol Y 最多能与 6 mol NaOH 反应
D.Y 与足量的H2加成反应的产物含 7 个手性碳原子
【答案】D
【解析】
A.由Y的结构可知,Y中含有的官能团为酚羟基、醚键、酯基,与NaHCO3不能发生反应,A错误;
B.Y中存在两个甲基,甲基为四面体结构,苯环为平面结构,所以Y分子中所有碳原子不一定在同一平面内,B错误;
C.Y中含有3个酚羟基和1个酯基,1molY含3mol酚羟基,可以与3molNaOH反应,1mol酯基可以与1molNaOH反应,故1molY最多能与4molNaOH反应,C错误;
D.Y与足量H2加成的产物为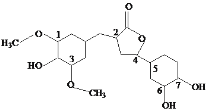 ,手性碳原子共7个,D正确;
,手性碳原子共7个,D正确;
答案选D。

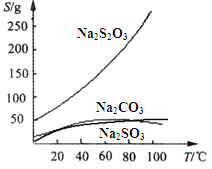
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S = Na2S2O3 。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
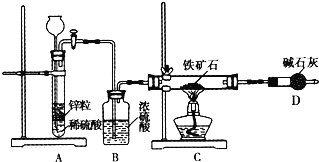
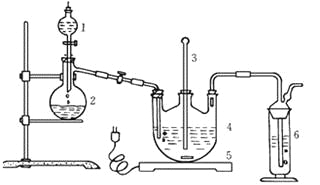
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为______________,装置6中可放入___________。
A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
![]()
(3)为减少产品的损失,操作①为__________,操作②是过滤洗涤干燥,其中洗涤操作是用________(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于__________(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:_____________________。
③产品中Na2S2O3·5H2O的质量分数为______________。