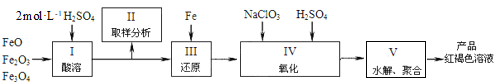
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
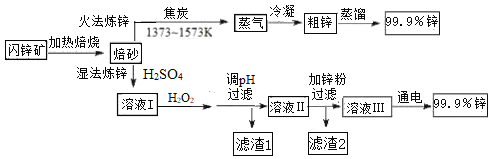
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
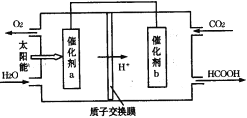
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。
【题目】根据所给信息和标志,判断下列说法错误的是( )
A | B | C | D |
碳酸氢钠药片
| 铜片制成的“纳米铜”在空气中易燃烧 |
| “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒 |
过量服用阿司匹林引起酸中毒后,可服用碳酸氢钠药片解毒 | 说明“钠米铜”的金属性比铜片强 | 看到有该标识的丢弃物,应远离并报警 | 在酿酒过程中,发生的反应有水解反应、氧化还原反应等 |
A.AB.BC.CD.D
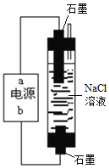
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
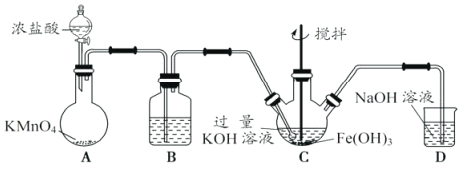
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
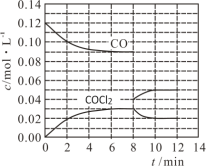
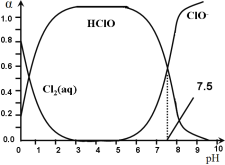
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)