题目内容
【题目】获取安全的饮用水成为人们关注的重要问题。回答下列问题:

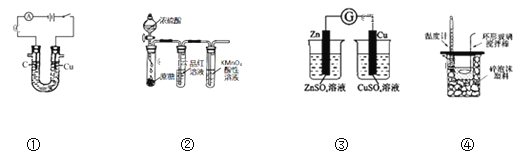
(1)漂白粉常用于自来水消毒。工业上用氯气和石灰乳制取漂白粉的化学方程式为_________。实验室用MnO2与浓盐酸反应制备Cl2 的反应装置如图所示,制备实验开始时先检查装置气密性,接下来的操作依次是_____________________(填下列序号)。
①往烧瓶中加入浓盐酸 ②加热 ③往烧瓶中加入MnO2粉末
(2)聚铁[Fe2(OH)n(SO4)3-0.5n]m是一种高效无机水处理剂,制备原理是调节Fe2(SO4)3溶液的pH,促进其水解制取。用铁的氧化物制取聚铁的流程如下:
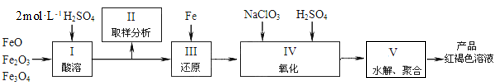
①实验室配制2mol·L-1的稀硫酸250mL需98%的浓硫酸(ρ=1.84g·mL-1)_______mL,配制过程中应使用的玻璃仪器有玻璃棒、烧杯、量筒、________________________。
②步骤Ⅳ中发生反应的离子方程式为_______________。
③步骤Ⅴ中需将溶液加热到70~80 ℃的目的是________________。Ⅴ中溶液的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的方法为_____________;若溶液的pH偏小,将导致聚铁中铁的质量分数__________(填“偏高”、“偏低”或“无影响”)。
(3)硬水易导致产生锅炉水垢[主要成分为CaCO3、Mg(OH)2、CaSO4],不仅会降低燃料的利用率,还会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。清除时首先用饱和Na2CO3溶液浸泡水垢,发生CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
【答案】2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O ③①② 27.2 胶头滴管、250mL容量瓶 6Fe2+ + ClO3- + 6H+ = 6Fe3+ + Cl- + 3H2O 促进Fe3+水解 将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比 偏低 2.5×104
【解析】
(1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,据此书写;加药顺序一般是先加入固体药品,再加入液体药品,最后再加热;
(2)根据流程:用稀硫酸溶解铁的氧化物得到硫酸亚铁、硫酸铁,取样,加入Fe还原得到硫酸亚铁溶液,再加入氯酸钠、稀硫酸氧化,得到Fe2(SO4)3溶液,调节pH促进其水解得到产品;
①密度为1.84gcm-3、98%的浓硫酸的物质的量浓度=(1000×1.84×98% /98)mol/L
=18.4mol/L,2molL-1的稀硫酸250mL的n(H2SO4)=0.5mol,据此计算;
②步骤Ⅳ中亚铁离子在酸性条件下被氯酸钠氧化生成铁离子氯酸根被还原成氯离子,据此书写;
③温度升高有利于水解;酸性较强,会使得聚铁中氢氧根偏少,硫酸根偏多,据此解答。
(1)据分析工业上用氯气和石灰乳制取漂白粉的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+H2O;实验室用MnO2与浓盐酸反应制备Cl2的反应装置如图所示,制备实验开始时先检查装置气密性,加药品先加入固体,再加入液体浓盐酸,最后加热,顺序为③①②;
(2)①密度为1.84gcm-3、98%的浓硫酸的物质的量浓度=(1000×1.84×98% /98)mol/L
=18.4mol/L,2molL-1的稀硫酸250mL的n(H2SO4)=0.5mol,需要浓硫酸的体积=0.5mol/(18.4mol/L)=27.2mL;配制250mL一定物质的量浓度溶液应使用的玻璃仪器有玻璃棒、烧杯、量筒、250mL容量瓶、胶头滴管;
②步骤Ⅳ中发生反应,亚铁离子在酸性条件下被氯酸钠氧化生成铁离子、氯酸钠中氯元素被还原成氯离子,反应为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
③步骤V中需将溶液加热到70~80℃的目的是促进Fe3+水解;pH试纸测定溶液pH的方法为将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比;若溶液的pH偏小,酸性较强,会使得聚铁中氢氧根偏少,硫酸根偏多,因而铁的质量分数偏低;
(3)已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9,CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq),![]() 。
。
。

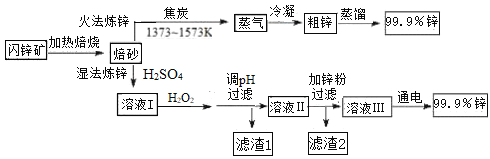
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。