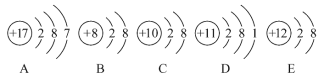
【题目】(1)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,发生反应2NO2(g)![]() N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
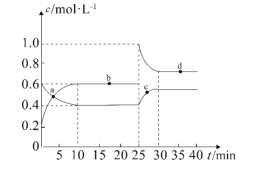
①0~10min的平均反应速率:v((NO2)=___________mol·L-1·min-1。
②a、b、c、d四个点中,表示化学反应速率v(正)>v(逆)的点是___________。
③上述反应反应进行到25min时,继续向容器内充入一定量NO2,重新达到平衡后,混合气体中NO2的体积分数将___________(填“增大”“不变”或“减小”)。该反应的平衡常数K=___________(计算结果保留1位小数)。
(2)一定温度下恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________(填标号)。
a.N2O分解反应中,k(含碘)>k(无碘)b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大d.I2浓度与N2O分解速率无关
(3)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
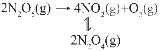
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
①25℃时2NO2(g)![]() N2O4(g)反应的平衡常数Kp=___________kPa-1。
N2O4(g)反应的平衡常数Kp=___________kPa-1。
②t=200min时,测得体系中p(N2O4)=6.5kPa,则此时的N2O5转化率为___________。(计算结果保留1位小数)
【题目】H2C2O4为二元弱酸,且具有还原性。
Ⅰ.20℃时,改变0.1mol·L-1H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4—、C2O42—的物质的量分数δ(X)随pH的变化如图所示。
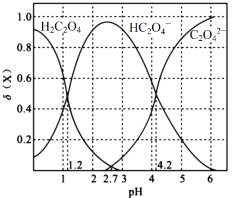
已知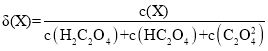
(1)Ka1(H2C2O4)=___________。
(2)0.1mol·L-1NaHC2O4溶液中离子浓度由大到小的顺序是___________。
(3)已知20℃时K(HCOOH)=1.77×10-4,向HCOONa溶液中加入少量H2C2O4,反应的离子方程式是___________。
Ⅱ.KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,因此使用前须用H2C2O4·2H2O配制的标准溶液标定(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)。
(4)准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(5)某学生根据3次实验分别记录有关数据如表所示,该KMnO4溶液的物质的量浓度为___________mol·L-1。
实验序号 | 消耗0.1000mol·L-1的H2C2O4溶液的体积/mL | 待测KMnO4溶液的体积/mL |
1 | 29.90 | 25.00 |
2 | 30.00 | 25.00 |
3 | 30.10 | 25.00 |
(6)在上述滴定过程中,下述操作可导致被测定的KMnO4浓度偏高的是___________
a.未用标准液润洗滴定管
b.达到滴定终点,读数时俯视液面
c.盛装待测液的锥形瓶用蒸馏水洗过,未润洗
d.滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
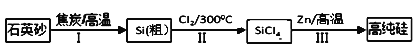
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。