题目内容
【题目】醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+,下列叙述正确的是( )
CH3COO-+H+,下列叙述正确的是( )
A.向溶液中加少量的CH3COONa固体或者降低温度,平衡均逆向移动,醋酸的电离常数Ka均减小
B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大
C.0.10mol/LCH3COOH溶液比0.010mol/LCH3COOH溶液中c(H+)大10倍
D.室温下,欲使0.1mol/L醋酸溶液的pH、电离度α都减小,可加入少量水
【答案】B
【解析】
A.弱电解质的电离是吸热反应,降低温度抑制电离,导致电离平衡常数减小,平衡常数只与温度有关系,加少量的CH3COONa固体平衡常数不变,故A错误;
B.加水稀释促进醋酸电离,但是电离增大程度小于溶液体积增大程度,导致溶液中c(H+)减小,但是温度不变离子积常数不变,c(OH-)增大,故B正确;
C.稀释促进电离,0.10mol/LCH3COOH溶液比0.010mol/LCH3COOH溶液的电离程度小,则0.10mol/LCH3COOH溶液比0.010mol/LCH3COOH溶液中c(H+)小10倍,故C错误;
D.加水稀释促进醋酸电离,但是电离增大程度小于溶液体积增大程度,导致溶液中c(H+)减小,pH增大,故D错误;
故答案选B。

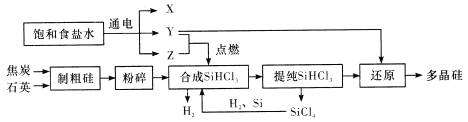
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
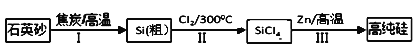
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。