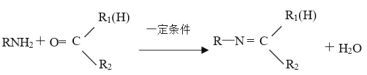
【题目】“结晶玫瑰”具有强烈的玫瑰香气,属于结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。“结晶玫瑰”的化学名称为乙酸三氯甲基苯甲酯,通常用三氯甲基苯基甲醇和醋酸酐为原料制备。
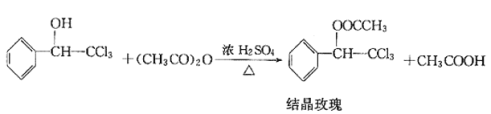
已知:
物质 | 在乙醇中的溶解性 | 在水中的溶解性 | 熔点℃ |
三氯甲基苯基甲醇 | 溶 | 不溶 | — |
醋酸酐 | 溶 | 溶 | -73 |
结晶玫瑰 | 溶 | 不溶 | 88 |
醋酸 | 易溶 | 易溶 | 16.6 |
部分实验装置以及操作步骤如下:
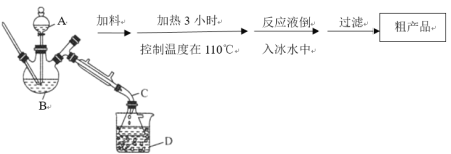
请根据以上信息,回答下列问题:
(1)装置中仪器B的名称是___________。
(2)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌。待混合均匀后,最适宜的加热方式为油浴加热,用油浴加热的理由是_______________。有同学认为装置中A仪器也可改为另一种漏斗,该漏斗的名称是___________,它的作用是____________。
现有同学设计如下方案把粗产品进行提纯。
(3)①将粗产品溶解在________(填“水”、“乙醇”或“粗产品滤液”)中均匀混合,用水浴加热到70℃,回流溶剂使粗产品充分溶解,得到无色溶液。然后将所得溶液经过__________(填操作方法)析出白色晶体,整个过程中不需要用到的仪器是_______(选择相应字母填空)。
A.冷凝管 B.烧杯 C.蒸发皿 D.玻璃棒
②将步骤①所得混合物过滤、洗涤、干燥得到白色晶体,请列举一种常见的实验室干燥的方法_______。可通过测定晶体的熔点判断所得晶体是否是结晶玫瑰,具体做法为:加热使其熔化测其熔点,实验现象为__________。
(4)ag的三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰bg,则产率是_________。(用含a、b的式子表示)