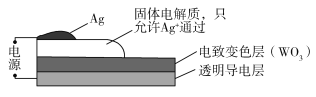
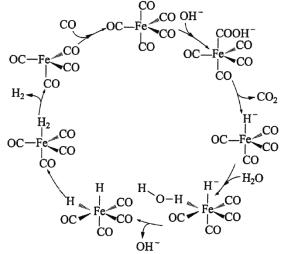
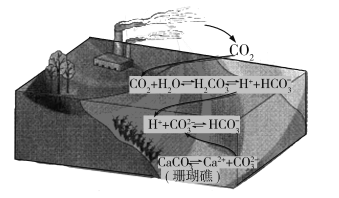
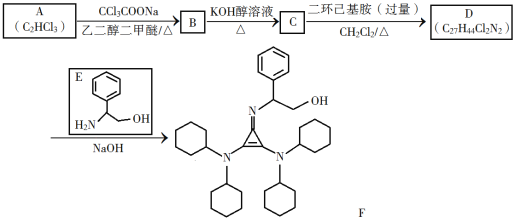
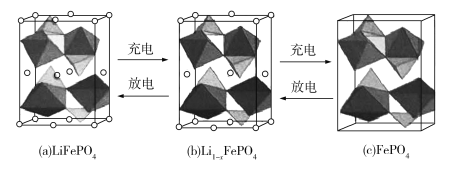
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1
【题目】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
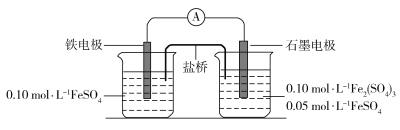
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
阳离子 | u∞×108/(m2·s1·V1) | 阴离子 | u∞×108/(m2·s1·V1) |
Li+ | 4.07 |
| 4.61 |
Na+ | 5.19 |
| 7.40 |
Ca2+ | 6.59 | Cl | 7.91 |
K+ | 7.62 |
| 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。