题目内容
【题目】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=98 kJ·mol1。回答下列问题:
SO3(g) ΔH=98 kJ·mol1。回答下列问题:
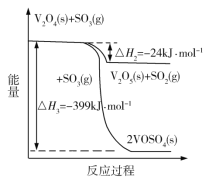
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________。
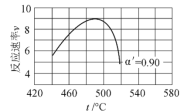
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α 随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。

(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(![]() 1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是__________________________。
【答案】2V2O5(s)+ 2SO2(g) 2VOSO4(s)+ V2O4(s) H= -351 kJmol-1 0.975 该反应气体分子数减少,增大压强,α提高。所以,该反应在550℃、压强为5.0MPa>2.5MPa=p2的,所以p1=5.0MPa 反应物(N2和O2)的起始浓度(组成)、温度、压强 ![]()
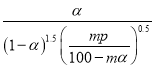 升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
【解析】
根据盖斯定律,用已知的热化学方程式通过一定的数学运算,可以求出目标反应的反应热;根据压强对化学平衡的影响,分析图中数据找到所需要的数据;根据恒压条件下总压不变,求出各组分的分压,进一步可以求出平衡常数;根据题中所给的速率公式,分析温度对速率常数及二氧化硫的转化率的影响,进一步分析对速率的影响。
(1)由题中信息可知:
①SO2(g)+![]() O2(g)SO3(g) H= -98kJmol-1
O2(g)SO3(g) H= -98kJmol-1
②V2O4(s)+ SO3(g)V2O5(s)+ SO2(g) H2= -24kJmol-1
③V2O4(s)+ 2SO3(g)2VOSO4(s) H1= -399kJmol-1
根据盖斯定律可知,③-②2得2V2O5(s)+ 2SO2(g) 2VOSO4(s)+ V2O4(s),则H= H1-2H2=( -399kJmol-1)-( -24kJmol-1)2= -351kJmol-1,所以该反应的热化学方程式为:2V2O5(s)+ 2SO2(g) 2VOSO4(s)+ V2O4(s) H= -351 kJmol-1;
(2) SO2(g)+![]() O2(g)SO3(g),该反应是一个气体分子数减少的放热反应,故增大压强可以使化学平衡向正反应方向移动。因此,在相同温度下,压强越大,SO2的平衡转化率越大,所以,该反应在550℃、压强为5.0MPa条件下,SO2的平衡转化率一定高于相同温度下、压强为2.5MPa的,因此,p1=5.0MPa,由图中数据可知,α=0.975。影响α的因素就是影响化学平衡移动的因素,主要有反应物(N2和O2)的浓度、温度、压强等。
O2(g)SO3(g),该反应是一个气体分子数减少的放热反应,故增大压强可以使化学平衡向正反应方向移动。因此,在相同温度下,压强越大,SO2的平衡转化率越大,所以,该反应在550℃、压强为5.0MPa条件下,SO2的平衡转化率一定高于相同温度下、压强为2.5MPa的,因此,p1=5.0MPa,由图中数据可知,α=0.975。影响α的因素就是影响化学平衡移动的因素,主要有反应物(N2和O2)的浓度、温度、压强等。
(3)假设原气体的物质的量为100mol,则SO2、O2和N2的物质的量分别为2m mol、m mol和q mol,2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:
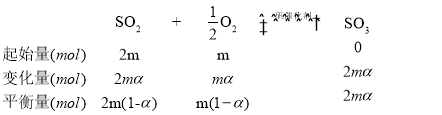
平衡时气体的总物质的量为n(总)= 2m(1-α)+m(1-α)+2mαmol+q mol,则SO3的物质的量分数为 。该反应在恒压容器中进行,因此,SO3的分压p(SO3)=
。该反应在恒压容器中进行,因此,SO3的分压p(SO3)=![]() ,p(SO2)=
,p(SO2)=![]() ,p(O2)=
,p(O2)=![]() ,在该条件下,SO2(g)+
,在该条件下,SO2(g)+ ![]() O2(g)2SO3(g) 的Kp=
O2(g)2SO3(g) 的Kp=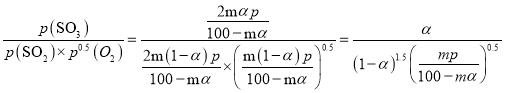 。
。
(4) 由于该反应是放热反应,温度升高后α降低。由题中信息可知,v=![]() ,升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低。
,升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低。

【题目】某同学通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有少量Na2O2的试管中加入蒸馏水,得到溶液a | 反应剧烈,产生能使带火星木条复燃的气体 |
然后向溶液a中滴入两滴酚酞 | 溶液先变红,再逐渐变浅,约10分钟溶液变为无色 |
为了探究溶液变为无色的原因,该同学按照科学的程序,进行了如下实验:
(推理与假设)
Na2O2与H2O反应的化学方程式_____。向溶液a中滴加酚酞本应只会变红,而实验中发现酚酞变红后又褪色。由此提出如下的假设:
假设A:O2有漂白性 假设B:NaOH有漂白性 假设C:O2和NaOH共同作用有漂白性
(实验与观察)
(2)请完成下表:
实验编号 | 1 | 2 | 3 |
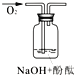
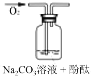
实验装置 |
|
|
|
实验假设 (填“A”、“B”或“C”) | 假设_____ | 假设____ | 假设__ |
实验现象 | 溶液变红后10分钟均无变化 | ||
实验结论 | _____ | ||
(查阅资料)
该同学查阅资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
(推理与假设)
该同学认为褪色的原因可能是溶液a中存在H2O2,H2O2漂白了酚酞。
(实验与观察)
(3)通过实验证实了H2O2的存在:取少量溶液a,加入黑色粉末____(填化学式),快速产生了能使带火星木条复燃的气体。该同学进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案:取少量溶液a于试管中,_____。
(解释与结论)
(4
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1