题目内容
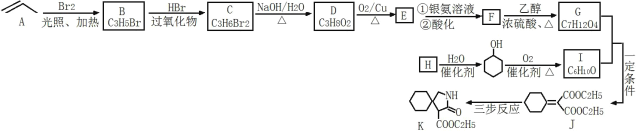
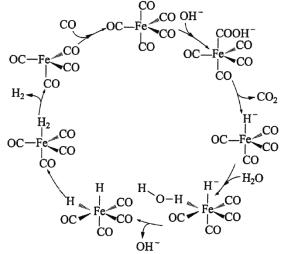
【题目】据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
A.OH-参与了该催化循环B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化
【答案】C
【解析】
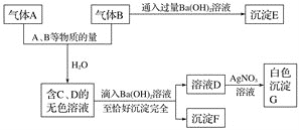
题干中明确指出,铁配合物Fe(CO)5充当催化剂的作用。机理图中,凡是出现在历程中,进去的箭头表示反应物,出来的箭头表示生成物,既有进去又有出来的箭头表示为催化剂或反应条件,其余可以看成为中间物种。由题干中提供的反应机理图可知,铁配合物Fe(CO)5在整个反应历程中成键数目,配体种类等均发生了变化;并且也可以观察出,反应过程中所需的反应物除CO外还需要H2O,最终产物是CO2和H2,同时参与反应的还有OH-,故OH-也可以看成是另一个催化剂或反应条件。
A.从反应机理图中可知,OH-有进入的箭头也有出去的箭头,说明OH-参与了该催化循环,故A项正确;
B.从反应机理图中可知,该反应的反应物为CO和H2O,产物为H2和CO2,Fe(CO)5作为整个反应的催化剂,而OH-仅仅在个别步骤中辅助催化剂完成反应,说明该反应方程式为![]() ,故有清洁燃料H2生成,故 B项正确;
,故有清洁燃料H2生成,故 B项正确;
C.由B项分析可知,该反应不是消耗温室气体CO2,反而是生成了温室气体CO2,故 C项不正确;
D.从反应机理图中可知,Fe的成键数目和成键微粒在该循环过程中均发生了变化,故 D项正确;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目