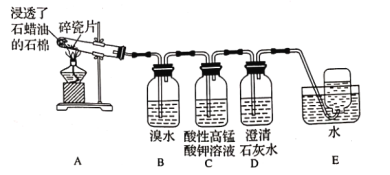
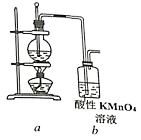
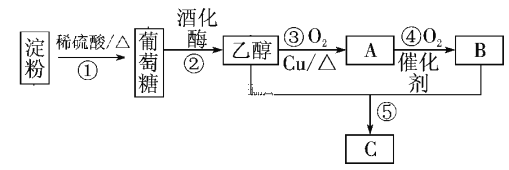
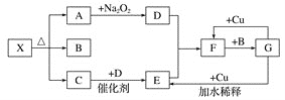
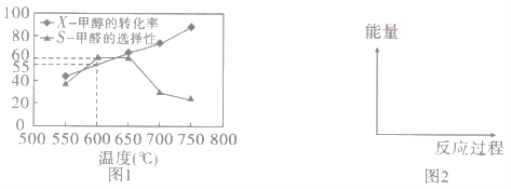
0 198746 198754 198760 198764 198770 198772 198776 198782 198784 198790 198796 198800 198802 198806 198812 198814 198820 198824 198826 198830 198832 198836 198838 198840 198841 198842 198844 198845 198846 198848 198850 198854 198856 198860 198862 198866 198872 198874 198880 198884 198886 198890 198896 198902 198904 198910 198914 198916 198922 198926 198932 198940 203614