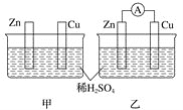
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下:
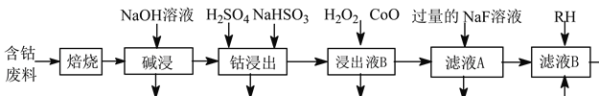
己知:①草酸钴晶体难溶于水
②RH为有机物,可用RH、有机溶剂萃取出溶液中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如表所示:
Fe3+ | Co2+ | |
开始沉淀时 | 1.9 | 7.1 |
沉淀完全时 | 3.7 | 9.1 |
(1)“焙烧”的目的_______。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为_______。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为_______。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为_______。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2mol·L1,则滤液中c(Ca2+)为_______mol·L1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)=_______。