��Ŀ����
����Ŀ��������أ�K2FeO4����һ�����͡���Ч�������ɫ����ˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ��Ӧ�ù㷺����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ�������ص���Ҫ��ӦΪ��2FeSO4��6Na2O2===2Na2FeO4��2Na2O��2Na2SO4��O2�����÷�Ӧ����������_____���ѧʽ����
��2��ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ�����������ӣ�Fe(OH)3��ClO��OH��FeO42-��Cl��H2O��
��д������ƽ����������ʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��________________________________��
��ÿ����1molFeO42-ת��________mol���ӣ�����Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ________mol��
��������ԭ��Ӧ������������Ӧ�ù㷺��˼���ش���������
��֪��2Fe3++2I===2Fe2++I2��2Fe2++Br2===2Fe3++2Br��2Fe2++Cl2===2Fe3++2Cl
��1������1mol FeI2��2mol FeBr2����Һ��ͨ��2mol Cl2����ʱ��������������________��
��2������a mol FeI2��b mol FeBr2����Һ��ͨ��c molCl2����Br������һ��ʱ��cΪ_______________���ú�a��b�Ĵ���ʽ��ʾ����
��3����֪��S2O![]() ���н�ǿ�Ļ�ԭ�ԣ�ʵ���ҿ���I���ⶨ�ⶨK2S2O8��Ʒ�Ĵ��ȣ��йط�Ӧ����ʽΪ�� I2+2S2O32-��2I+S4O62-��S2O82-+2I��2SO42-+I2����S2O82-��S4O62-��I2������ǿ��˳��Ϊ��____________��
���н�ǿ�Ļ�ԭ�ԣ�ʵ���ҿ���I���ⶨ�ⶨK2S2O8��Ʒ�Ĵ��ȣ��йط�Ӧ����ʽΪ�� I2+2S2O32-��2I+S4O62-��S2O82-+2I��2SO42-+I2����S2O82-��S4O62-��I2������ǿ��˳��Ϊ��____________��
��4����֪��Һ�У���ԭ��HSO3->I����������IO3->I2>SO42-����3molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ��
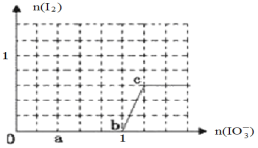
д��a�㴦��ԭ������_______________��b�㵽c�㷴Ӧ�����ӷ���ʽ________________
���𰸡�Na2FeO4��O2 2Fe(OH)3+3ClO+4OH = 2FeO42-+ 3Cl+5H2O 3 0.15 I��Fe2+ (3a+2b)/2 S2O82->I2 >S4O62- I IO3-+5I-+6H+=3I2 +3H2O
��������
I.��1�����������ǻ�ԭ����������FeSO4�У�2��Feת���ɣ�6�ۣ����ϼ����ߣ�Na2O2�У�1��O��0�ۣ����ϼ����ߣ�������������������Na2FeO4��O2��
��2�����Ʊ�������أ�Fe�Ļ��ϼ����ߣ���ClO����������������ԭ��Cl��������Ϊ���ԣ����ʪ���Ƹ�����ص����ӷ���ʽΪ2Fe(OH)3��3ClO����4OH��=2FeO42����3Cl����5H2O��
��ÿ����1molFeO42����ת�Ƶ������ʵ���Ϊ1mol��(6��3)=3mol����ԭ������Cl����Cl�Ļ��ϼ��ɣ�1�ۡ���1�ۣ����ϼ۱仯2�ۣ����ת�Ƶ������ʵ���0.3mol������n(Cl��)=0.3mol/2=0.15mol��
II.��1����������������Ӧ����ʽ���ó���ԭ��ǿ����˳����I��>Fe2>Br������û����Һ��ͨ����������Ӧ���Ⱥ�˳����2I����Cl2=2Cl����I2��2Fe2����Cl2=2Fe3����2Cl����2Br����Cl2=Br2��2Cl�������Һ�к���2molI��������Cl2�����ʵ���Ϊ1mol����ʣ1molCl2��Fe2�����ʵ���Ϊ3mol����ȫ��Ӧʱ������Cl2�����ʵ���Ϊ3mol/2=1.5mol>1mol�����ֻ�б�������Fe2�����ʵ���Ϊ2mol��������������������������I����Fe2����
��2�����ݵ�ʧ������Ŀ�غ��У�2amol��1��(a��b)mol��1��2b��1/2=cmol��2��1�����c=(3a��2b)/2��
��3��������������������ǿ����������������ԣ��������ӷ���ʽ���Ⱥ�˳��ó�������ǿ��˳����I2>S4O62����S2O82��>I2��������ǿ��˳����S2O82��>I2>S4O62����
��4�����ݻ�ԭ���Լ�������ǿ����˳��IO3����SO32��������SO42������������ԭ��I������0��1�η������ӷ���ʽΪIO3����3HSO3��=I����3SO42����3H������a�㻹ԭ����ΪI����b��c�������ӷ���ʽΪ��IO3��+5I��+6H��=3I2 +3H2O��