【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反应②是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在____(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___v(逆)(填“>”、“=”或“<”)。
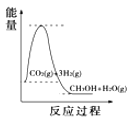
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A. B.
B.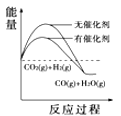 C.
C.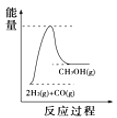 D.
D.