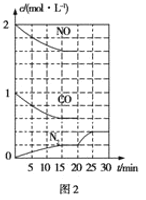
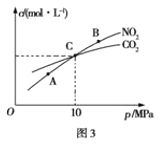
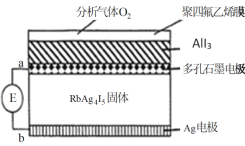
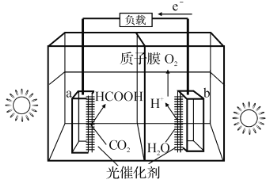
题目内容
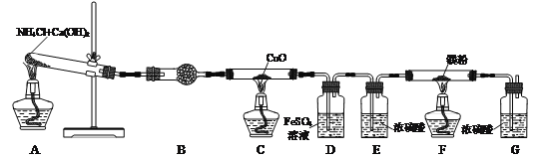
【题目】氮化镁(Mg3N2)是一种高强度钢冶炼的添加剂,现某学习小组利用下列装置制备少量氮化镁。
已知:Ⅰ.3Mg+N2![]() Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(1)检查该装置气密性的方法是___。
(2)写出装置A中发生反应的化学方程式:___,装置B中试剂的名称是___。
(3)反应一段时间后装置C中黑色固体变为红色,并有水珠出现。装置C中发生反应的化学方程式为___。
(4)装置D中FeSO4溶液的作用是___。
(5)实验过程中装置A和F应该先加热的是___处。
(6)装置F中有氮化镁生成,写出通过实验验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,___,说明其中含氮化镁。
【答案】在装置A处微微加热,G处出现气泡,(停止微热后,G中导管内出现一段水柱) Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+H2O 碱石灰 3CuO+2NH3
CaCl2+2NH3↑+H2O 碱石灰 3CuO+2NH3![]() 3Cu+N2+3H2O 吸收装置中的O2,以免O2与Mg发生反应 A 加入少量水,微热,用湿润的红色石蕊试纸于试管口检验所得气体,若气体变蓝
3Cu+N2+3H2O 吸收装置中的O2,以免O2与Mg发生反应 A 加入少量水,微热,用湿润的红色石蕊试纸于试管口检验所得气体,若气体变蓝
【解析】
(1)用加热法检查该装置气密性;
(2)装置A中氯化铵和氢氧化钙在加热条件下生成氯化钙、氨气、水;装置B的作用是除去氨气中的水蒸气;
(3)反应一段时间后装置C中黑色氧化铜固体变为红色,并有水珠出现,说明氨气与氧化铜反应生成铜、氮气、水;
(4)FeSO4具有还原性,能吸收空气中的氧气;
(5)为防止氧气与镁反应,应先通一段时间的氨气,排出装置中的空气;
(6)根据Mg3N2+6H2O=3Mg(OH)2+2NH3↑,检验Mg3N2的存在。
(1). 在装置A处微微加热,G处出现气泡,停止微热后,G中导管内出现一段水柱,说明装置气密性良好;
(2)装置A中氯化铵和氢氧化钙在加热条件下生成氯化钙、氨气、水,反应方程式是Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+H2O;装置B的作用是除去氨气中的水蒸气,装置B中试剂的名称是碱石灰;
CaCl2+2NH3↑+H2O;装置B的作用是除去氨气中的水蒸气,装置B中试剂的名称是碱石灰;
(3)反应一段时间后装置C中黑色氧化铜固体变为红色,并有水珠出现,说明氨气与氧化铜反应生成铜、氮气、水,反应方程式是3CuO+2NH3![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(4)FeSO4具有还原性,能吸收空气中的氧气,装置D中FeSO4溶液的作用是吸收装置中的O2,以免O2与Mg发生反应;
(5)为防止氧气与镁反应,应先通一段时间的氨气,排出装置中的空气,所以应该先加热的是A处;
(6)Mg3N2+6H2O=3Mg(OH)2+2NH3↑,验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,加入少量水,微热,用湿润的红色石蕊试纸于试管口检验所得气体,若气体变蓝,说明其中含氮化镁。

【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0