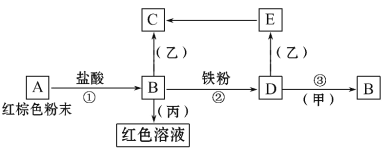
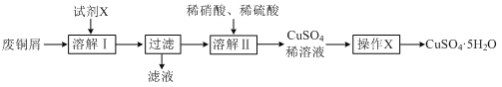
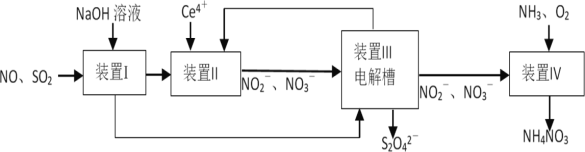
��Ŀ����
����Ŀ��X��Y��Z��W��R�������ڱ���ǰ20������Ԫ�أ���ԭ��������������Ԫ��X�ĵ����ǿ�������������������壬Z��Ԫ�����ڱ��зǽ�������ǿ��Ԫ�أ�Z��W��ͬ��Ԫ�أ�R�����������������ڲ��������һ�롣����˵����ȷ���ǣ� ��
A.Ԫ��X��Y�γɵĻ������Ϊ��ɫ����
B.Ԫ��Z��W��������۾�Ϊ��7��
C.X���⻯����W���⻯�����������ɰ���
D.������R2Y2�������Ӻ������ӱ���Ϊ1��1
���𰸡�C
��������
Ԫ��X�ĵ����ǿ�������������������壬X��NԪ�أ�Z��Ԫ�����ڱ��зǽ�������ǿ��Ԫ�أ�Z��FԪ�أ�Z��W��ͬ��Ԫ�أ�W��ClԪ�أ�R�����������������ڲ��������һ�룬R��KԪ�أ�X��Y��Z��W��Rԭ������������������Y��OԪ�ء�
A. Ԫ��N��O�γɵĻ������У�NO2Ϊ����ɫ���壬��A����
B. FԪ��û�����ۣ���B����
C. NH3��HCl���������ɰ���NH4Cl����C��ȷ��
D. ������K2O2�е���������![]() �������Ӻ������ӱ���Ϊ2��1����D����
�������Ӻ������ӱ���Ϊ2��1����D����

����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�պ����Ҫ���
��1�������������ڰ�װ�Ĵ�ת��������ʹ����β���е���Ҫ��Ⱦ��ת��Ϊ���Ĵ���ѭ�����ʡ���֪��N2(g)��O2(g)===2NO(g)��H=��180.5kJ��mol��1
2C(s)��O2(g)===2CO(g)��H=��221.0kJ��mol��1
C(s)��O2(g)===CO2(g)��H=��393.5kJ��mol��1
��Ӧ2NO(g)��2CO(g)===N2(g)��2CO2(g)����H=________kJ��mol��1��
��2����֪����ӦCO2(g)![]() CO(g)+O(g)���ܱ�������CO2�ֽ�ʵ��Ľ����ͼ1����Ӧ2CO2(g)
CO(g)+O(g)���ܱ�������CO2�ֽ�ʵ��Ľ����ͼ1����Ӧ2CO2(g)![]() 2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2��
2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2��
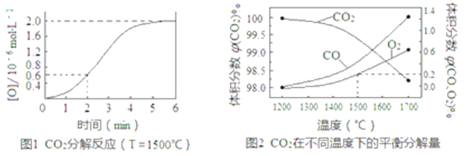
�ٷ���ͼ1����2min��v(CO2)=_______��5minʱ�ﵽƽ�⣬ƽ��ʱc��CO��=_______��
�ڷ���ͼ2��1500��ʱ��Ӧ��ƽ�⣬��ʱ�������Ϊ1L����Ӧ��ƽ�ⳣ��K=______(����������1λС��)��
��3��Ϊ̽����ͬ������CO��H2�ϳ�CH3OH��ѡ����Ч����ijʵ���ҿ���CO��H2�ij�ʼͶ�ϱ�Ϊ1��3����ʵ�飬�õ��������ݣ�
ѡ�� | T/K | ʱ��/min | �������� | �״��ĺ���(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
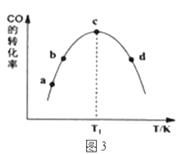
���ɱ�1��֪���÷�Ӧ����Ѵ���Ϊ____________�����ţ���ͼ3��a��b��c��d�ĵ��Ǹ��¶���CO��ƽ��ת���ʵ���____________��
�����������COת��ΪCH3OH��ƽ��ת���ʵĴ�ʩ��____________��
A��ʹ�ô���CuO��ZnO��ZrO2B���ʵ����ͷ�Ӧ�¶�
C������CO��H2�ij�ʼͶ�ϱ�D�������£��ٳ���amolCO��3amolH2
����Ŀ��ij�о���ѧϰС��ͬѧΪ��̽��������ͬ���¶Ⱥ�ѹǿ�£���ͬ������κ����嶼������ͬ��Ŀ�ķ������������Խ̲�����أ���ѧ̽����Ϊ�������������ͼʵ��װ�ò���¼���ʵ�����ݡ�
��ʵ��װ�ã�
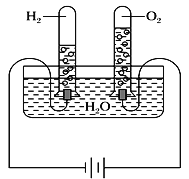
������ʵ�����ݣ�
�¶� | ѹǿ | ʱ�� | ˮ����H2O������ | H2��� | O2��� |
30 �� | 101 kPa | 0 | 300 g | 0 | 0 |
30 �� | 101 kPa | 4���� | 298.2 g | 1.243 L |
��ش��������⣺
(1)4����ʱH2��O2�����ʵ����ֱ���________mol��________mol��
(2)���¶��£�����Ħ�������__________��
(3)�ڸ�ʵ�������£�3 mol O2����������Ϊ____________L