��Ŀ����
����Ŀ���ҹ���ѧ�Һϳɵĸ��Ļ����ͨ���������[ph3C]+[B(C6F5)4]-�����ϩ�ۺϱ���ϺõĴ����ԡ��ϳ����Ļ����������һ����Ӧ���£��÷�Ӧ�漰H��C��N��O��Cl��Cr�ȶ���Ԫ�ء�

�ش��������⣺
(1)����״̬�����У����������һ��������������������_____________(����)��
A��![]() B��
B��![]()
C��![]() D��
D��![]()
(2)����������̼ԭ�Ӳ�ȡ���ӻ���ʽΪ______�����������a��b��n��m���Ļ�ѧ������λ������______(����ĸ)����
(3)Cr3+���н�ǿ���ȶ��ԣ�Cr3+�ĺ�������Ų�ʽΪ______����֪û��δ�ɶ�d���ӵĹ��ɽ��������γɵ�ˮ����������ɫ�ģ�Ti4+��V3+��Ni2+�������ӵ�ˮ������Ϊ����ɫ����______(�����ӷ���)��
(4)ClO3-�ļ���С��ClO4-�ļ��ǣ�ԭ����______��
(5)���ݽṹ�����ʵĹ�ϵ���ͣ�HNO2�����Ա�HNO3����ԭ��______��
(6)ˮ�ںϳɸ��Ļ�����Ĺ��������ܼ����о�����ˮ�������13�����͵Ľᾧ�塣�����ر�(�ܶȱ�ˮ��)����������ϵ��������������x��y��z���ͶӰͼ��ͼ��ʾ�������е�H2O��λ��Ϊ_____�����߳�Ϊa pm�����ر����ܶ�Ϊ ____g��cm-3��д����ѧ����ʽ��NAΪ����٤����������

���𰸡�D sp2��sp3 b 1s22s22p63s23p63d3 Ti4+ ClO3-����ԭ����һ���µ��Ӷԣ�ClO3-�йµ��Ӷ���ɼ����Ӷ�֮����ų�������ClO4-�гɼ����ӶԼ���ų����� HNO2��HNO3�ɱ�ʾΪ(HO)NO��(HO)NO2��(HO)NO��NΪ+3�ۣ�(HO)NO2��NΪ+5�ۣ������Ը��ߣ�ʹN-O-H��O�ĵ��Ӹ���Nƫ�ƣ���ʹ���������H+ 8 ![]() ��1030
��1030
��������
(1)ͬһԭ�ӣ�����������������ʧȥ������Խ�࣬�ڵ��������һ��������������Խ��������
(2)����������̼ԭ���б���̼ԭ�Ӻ��γɱ�����̼ԭ���������ͣ��ݴ˷����ӻ���ʽ��
������λ����һ��ԭ�ӵ������ṩ���Ӷ�������ԭ�ӹ��ã���ϻ��������a��b��n��m���Ļ�ѧ��������
(3)���ݹ���ԭ����дCrԭ�Ӻ�������Ų�ʽ��Crԭ��ʧȥ3�������ϸߵĵ��ӵõ�Cr3+���ݴ���д������Ų�ʽ������û��δ�ɶ�d���ӵĹ��ɽ��������γɵ�ˮ����������ɫ�ģ���Ti4+��V3+��Ni2+�������ӵĺ�������Ų������жϣ�
(4)��������ԭ�ӵĵ����γɻ�ѧ���������Ϲµ��ӶԵ��ų����ô��ڳɼ����ӶԵ��ų����÷����жϣ�
(5)���ݷ������ǻ��ܵ�����ԭ����������С������
(6)����������x��y��z���ͶӰͼ��ͼ��֪Ϊ���������ѻ�������λ��Ϊ8��ÿ��������ˮ���Ӹ���Ϊ2�����ù�ʽ��=![]() ���㾧���ܶȡ�
���㾧���ܶȡ�
(1)A��C��ʾ��������Clԭ�ӣ�����A�ǻ�̬��C�Ǽ���̬�������е�������C��A�����ȶ��ԣ�A��C������ʧȥ1��������Ҫ������A��C��
B��D��ʾ������Cl+����Clԭ��ʧȥ1�����Ӻ�õ��ģ������е�������B��D�����ȶ��ԣ�D��B������ʧȥ1��������Ҫ������D��B���Ӵ�һ����λ����ɵ���������ʧȥ1��������Ҫ������Ҫ�ȴ�����ԭ��ʧȥ1��������Ҫ�������ߣ�����ѡ����ʧȥ1��������Ҫ����������D��ʾ������
(2)����������̼ԭ���б���̼ԭ�Ӻ��γɱ�����̼ԭ���������ͣ�����Cԭ�Ӳ���sp3�ӻ����γɱ�����Cԭ�Ӳ���sp2�ӻ���
����ͼʾ��֪���ڻ��������a��b��n��m���Ļ�ѧ����a��n��m����һ�㹲�ۼ�����b����Nԭ���ṩ���Ӷ���Crԭ�ӹ��ã���˸ù��ۼ�Ϊ��λ����
(3)Cr��24��Ԫ�أ����ݹ���ԭ���ɵ�Crԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d44s2��Crԭ��ʧȥ2��4s���Ӻ�1��3d���ӵõ�Cr3+����������Ų�ʽΪ��1s22s22p63s23p63d3��
Ti4+��������Ų��ǣ�1s22s22p63s23p4��û��3d���ӣ�����ˮ������Ϊ����ɫ��
V3+��������Ų��ǣ�1s22s22p63s23p63d2����δ�ɶ�d���ӣ���ˮ������Ϊ����ɫ��
Ni2+��������Ų��ǣ�1s22s22p63s23p63d8����δ�ɶ�d���ӣ���ˮ������Ϊ����ɫ������������������ˮ����������ɫ����Ti4+��
(4)ClO3-����ԭ����һ���µ��Ӷԣ�ClO3-�йµ��Ӷ���ɼ����Ӷ�֮����ų�������ClO4-�гɼ����ӶԼ���ų��������¼��ǣ�ClO3-��ClO��-��
(5)HNO2��HNO3����һԪ�ᣬ�����ж�����1��-OH���ɷֱ��ʾΪ(HO)NO��(HO)NO2��(HO)NO��NΪ+3�ۣ�(HO)NO2��NΪ+5�ۣ������Ը��ߣ�ʹN-O-H��O�ĵ��Ӹ���Nƫ�ƣ���ʹ���������H+��������ԣ�HNO2��HNO3��
(6)����������x��y��z���ͶӰͼ��ͼ��֪Ϊ���������ѻ�������λ��Ϊ8��ÿ��������ˮ���Ӹ���Ϊ![]() ��8+1=2�����ɾ����ܶ���=
��8+1=2�����ɾ����ܶ���=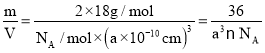 ��1030g/cm3��
��1030g/cm3��

����Ŀ��Ŀǰ��ҵ�Ͽ�����CO��CO2������ȼ�ϼ״���ij�о�С��������йؼ״���ȡ��������ѧ��Ӧԭ������̽������֪�ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ��(K1��K2��K3)�����ʾ����ش��������⣺
��ѧ��Ӧ | �ʱ� | ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |||
��2H2(g)��CO(g) | ��H1 | K1 | 2.5 | 0.34 | 0.15 |
��CO2(g)��H2(g) | ��H2 | K2 | 1.0 | 1.70 | 2.52 |
��CO2(g)��3H2(g) | ��H3 | K3 | |||
��1����Ӧ����____(��������������������)��Ӧ��
��2�����ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=____(��K1��K2��ʾ)�����ݷ�Ӧ���ж���S___0(������������������������)����____(�����ϸ��������ϵ���)�¶��������ڸ÷�Ӧ�Է����С�
��3��500��ʱ����÷�Ӧ����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.1mol/L��0.8mol/L��0.3mol/L��0.15mol/L�����ʱv(��)___v(��)(������������=����������)��
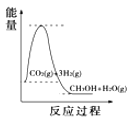
��4�����������������ʱ䣬����������ϵͼ��������_____
A. B.
B. C.
C. D.
D.