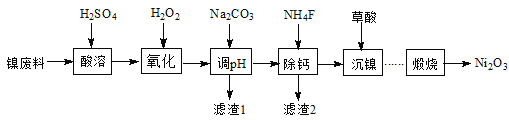
【题目】某科研小组采用电解锰粉(主要成分为Mn和少量含Fe、Ni、Pb、P、Si等元素的单质或其化合物)为原料制备高纯氯化锰。
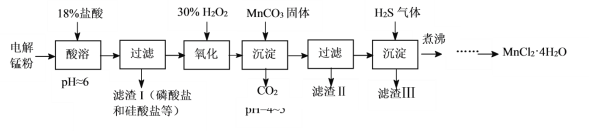
已知:①Mn是一种比Fe活泼的金属。
②H2S气体具有较强的还原性,如:H2S+H2O2=S↓+2H2O。
③相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Fe2+ | Mn2+ | Ni2+ | Pb2+ | |
开始沉淀的pH | 1.1 | 5.8 | 8.6 | 6.7 | 8.0 |
沉淀完全的pH | 3.2 | 8.8 | 10.1 | 9.2 | 8.8 |
(1)酸溶时盐酸要缓慢滴加的原因是___。
(2)加入MnCO3固体时发生反应的离子方程式为___。MnCO3固体也可用下列物质代替___。(填写编号)
A.MnO B.MnSO4 C.Mn(OH)2 D.MnCl2
(3)通入H2S气体可使Pb2+、Ni2+生成硫化物沉淀,如:H2S(aq)+Pb2+(aq)![]() PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
(4)煮沸的目的是___。
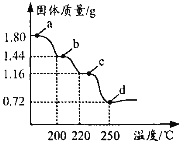
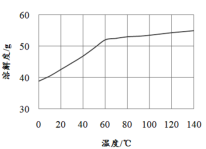
(5)已知MnCl2·4H2O在106℃时失去一分子结晶水,198℃失去全部结晶水。请补充完整由煮沸后的滤液获得高纯(>99.99%)MnCl2·4H2O晶体(MnCl2的溶解度曲线如图所示)的实验方案:将煮沸后的滤液冷却至室温,___(实验中须使用的试剂是:30%H2O2)。
【题目】已知反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
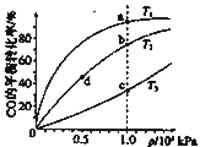
A.平横常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)=v(d)
C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D.平均相对分子质量:M(a)=M(c),M(b)>M(d)