题目内容
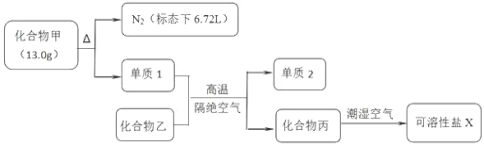
【题目】工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经高温煅烧NiC2O4制取Ni2O3的流程如图:
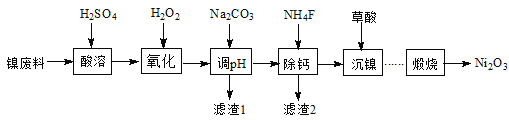
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时硫酸不宜过多的原因为________。
(2)加入H2O2发生的主要反应的离子方程式为________;
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为_________。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5 mol·L-1],则“除钙”时需控制NH4F的浓度至少为_______mol·L-1。
(5)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为_____。
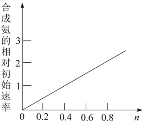
(6)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时,合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是_______。
【答案】防止调pH时消耗过多Na2CO3 2Fe2++H2O2+2H+=2Fe3++2H2O 促进Fe3+水解,使其沉淀完全 0.004 2NiC2O4![]() Ni2O3+3CO↑+CO2↑ Co2+
Ni2O3+3CO↑+CO2↑ Co2+
【解析】
向镍废料(镍、铁、钙合金为主)中加入硫酸,废料中的金属与稀硫酸反应产生NiSO4、FeSO4、CaSO4,向溶液中加入H2O2,可以将Fe2+氧化为Fe3+,加入碳酸钠溶液调节溶液的pH,使Fe3+全部形成Fe(OH)3沉淀,得到滤渣1是Fe(OH)3沉淀,向滤液再加入NH4F溶液,使Ca2+离子形成CaF2沉淀除去,则沉淀2是CaF2,过滤得到溶液含有Ni2+离子的溶液,在溶液中加入草酸生成NiC2O4,将溶液蒸发浓缩、冷却结晶得到NiC2O4晶体,将晶体煅烧产生Ni2O3。
(1)加入硫酸进行酸溶处理,目的是使合金中的金属元素形成阳离子进入溶液,若加入硫酸过多,后面加入Na2CO3溶液调节pH时就会消耗过多Na2CO3溶液,因此硫酸不能过多;
(2)H2O2具有强的氧化性,可以将溶液中的Fe2+氧化为Fe3+,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)酸溶后的溶液中含有过量硫酸电离产生的H+,加入Na2CO3溶液调节pH至4.0~5.0,可以使Fe3+水解形成Fe(OH)3沉淀,从而达到除去Fe3+的目的,该反应的方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(4)根据CaF2的Ksp(CaF2)=c(Ca2+)·c2(F-)=1.610-10,当溶液中Ca2+沉淀完全时,由于c(Ca2+)≤1.010-5 mol·L-1, c(F-)最小为:![]() =0.004 mol/L;
=0.004 mol/L;
(5)NiC2O4高温煅烧产生Ni2O3,同时会产生CO、CO2,可获得两种化合物气体,该反应的化学方程式为2NiC2O4![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
(6)Ni2O3可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。从图可知:催化剂中n值越大,合成氨的相对初始速率越大。催化剂中n值越大,则催化剂ConNi(1-n)Fe2O4中Co2+的含量越大,由此可知Co2+、Ni2+两种离子中催化效果更好的是Co2+。

 寒假学与练系列答案
寒假学与练系列答案【题目】某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
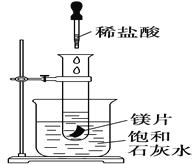
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
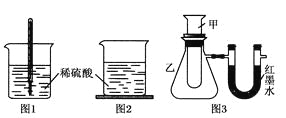
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红
墨水液面高低判断某反应是吸热反应还是放热反应。
序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
① | 氧化钙与水 | 左低右高 |
② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
③ | 铝片与烧碱溶液 | 左低右高 |
④ | 铜与浓硝酸 | 左低右高 |
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写 出该反应的离子方程式:___________。
(2)方案一中,温度升至最大值后又下降的原因是___________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为________,说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量