题目内容
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是一种浅绿色晶体,广泛应用于电镀工业。为探 究其分解产物,某学习小组利用如图所示装置进行实验。
(查阅资料)隔绝空气加热至500°C时,摩尔盐能完全分解,分解产物中有铁氧化物, 硫氧化物,氨气和水蒸气等。

(1)对A装置加热前,先通一段时间N2的目的是_______。
(2)实验开始一段时间后,装置B中的现象为______。
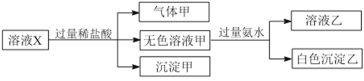
(3)实验中观察到装置D始终无明显现象,装置C中和E中均产生白色沉淀。
①写出E中SO2与H2O2发生反应的化学方程式:_______。
②甲同学根据C中产生白色沉淀现象判断产物中一定含有SO3。请对甲同学的判断作出评价,并说明理由:_____。
(4)实验结束后,装置A中的固体变为红棕色,请补充完整检验该残留固体中是否含 FeO或Fe3O4的实验方案:取A中少量残留固体,加入稀硫酸使其完全溶解,向 溶液中滴加 ________,若观察到 ______,说明残留固体中不含FeO和Fe3O4。(提供的试剂有:NaOH溶液、氯水、硫氰化钾溶液、酸性高锰酸钾溶液)
【答案】排尽装置内的空气,防止氧气干扰 B中白色固体变蓝 SO2 + H2O2 =H2SO4 甲同学的判断不正确。若摩尔盐分解产生的NH3溶于C瓶,溶液呈碱性,则可能生成BaSO3沉淀 少量酸性高锰酸钾溶液 溶液紫色未褪去
【解析】
由题给实验装置图可知,装置A为摩尔盐受热分解装置,装置B为水的检验装置,装置C中盐酸吸收氨气,氯化钡用于检验三氧化硫,装置D中氯化钡用于证明三氧化硫被完全吸收,防止三氧化硫干扰二氧化硫的检验,装置E中双氧水用于氧化二氧化硫,氯化钡用于证明二氧化硫生成。
(1)对A装置加热前,先通一段时间N2的目的是排尽装置内的空气,防止氧气干扰实验,故答案为:排尽装置内的空气,防止氧气干扰;
(2)装置B无水硫酸铜是检验分解产物水,所以看到的现象为白色固体变蓝色,故答案为:B中白色固体变蓝色;
(3)①装置E中SO2与H2O2发生氧化还原反应生成硫酸,反应的化学方程式为SO2 + H2O2 =H2SO4,故答案为:SO2 + H2O2 =H2SO4;
②装置C中盐酸吸收氨气,若盐酸不足,极易溶于水的氨气溶于水使溶液呈碱性,二氧化硫也能与氯化钡反应生成亚硫酸钡表示沉淀,则甲同学的判断不正确,故答案为:甲同学的判断不正确。若摩尔盐分解产生的NH3溶于C瓶,溶液呈碱性,则可能生成BaSO3沉淀;
(4)若A中少量残留固体完全溶于稀硫酸所得溶液中不含有亚铁离子,则说明残留固体中不含FeO和Fe3O4,由提供的试剂可知,向所得溶液中滴加酸性高锰酸钾溶液,溶液紫色未褪去,说明不含有亚铁离子,故答案为:少量酸性高锰酸钾溶液;溶液紫色未褪去;

【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
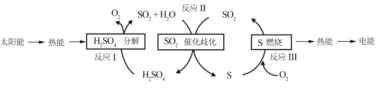
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
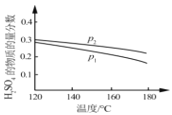
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。