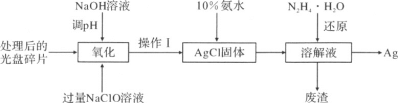
【题目】某小组研究NH4Cl与CuO的反应,进行如下实验(部分装置略):
实验 | Ⅰ | Ⅱ |
装置 |
|
|
现象 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 | 将细玻璃管口加热至红热,迅速垂直插入 NH4Cl晶体中,一段时间后,取出玻璃管,管口处有亮红色固体 |
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是______。
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
![]()
①(NH4)2CuCl4固体受热分解的化学方程式是______。
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl。
反应方程式为:________________________________(补充完整)
ⅱ.X是______,理由是______。
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是______(列出2点)。
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1 mol·L1 NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和Cu(NH3)42+深蓝色
ⅱ.Cu(NH3)2+![]() Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+![]() Cu2++4NH3
Cu2++4NH3
①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或Cu(NH3)42+。
实验方案是______。
②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是______(列出1点即可)。
【题目】下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题.
周期 |
|
|
|
|
|
|
| 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)10种元素中,化学性质最不活泼的是_________.
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是_________.
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________.
(4)元素⑦的简单氢化物的化学式为_____;若该氢化物和元素⑨的单质反应,则化学方程式为_______.
(5)⑤和⑨的最高价氧化物对应水化物的化学式分别为_________和_________.
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式为__________________.