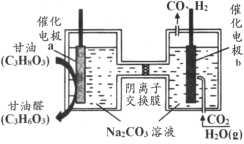
【题目】用如图所示装置测定镁带样品中单质镁的质量分数。(杂质与酸反应不产生气体)
完成下列填空:
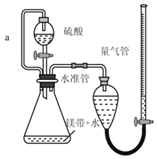
(1)硫酸必须过量的目的是_____
(2)导管a的作用是_____
(3)取两份镁带样品分别进行实验,所得数据见下表:
实验次数 | 镁带质量(g) | 氢气体积(mL)(已换算成标准状况) |
1 | 0.053 | 44.60 |
2 | 0.056 | 47.05 |
单质镁的质量分数是_____。(保留3位小数)
(4)如果测定结果偏高,可能的原因是_____。(选填编号)
a.装置漏气
b.未冷却至室温即读数
c.镁带中含有氧化镁
d.末读数时量气管的液面低于水准管
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
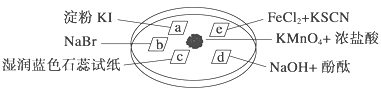
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D