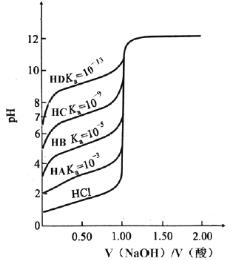
【题目】一定温度下,将1 mol X和3 mol Y置于2 L的恒容密闭容器中,发生反应:X(g)+3Y(g)2Z(g),反应过程中部分数据如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
p/kPa | 32 | 28.8 | 27.2 | 26.88 | 26.88 |
下列说法正确的是
A.10min时,用Y表示的平均反应速率为0.03 mol·L-1·min-1
B.X和Y的转化率之比保持不变时,可判断反应达到平衡状态
C.平衡状态时,c(Z)=0.32 mol·L-1
D.用气体分压代替物质的量浓度计算该反应的平衡常数,数值不变
【题目】学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、___、___、___等;
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
实验编号 | KClO3质量(g) | 氧化物化学式 | 氧化物质量(g) | 氧化物回收率 | 产生气体(mL)(已折算到标况) | 耗时(s) |
1 | 0.60 | 10 | 480 | |||
2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、____;
b.实验编号3的实验中KClO3的分解率为____%(保留一位小数);
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是___(填分子式),可用____试纸检验,上述异常现象产生的原因是____;
(5)实验结论:____。
【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:
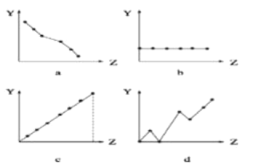
(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。