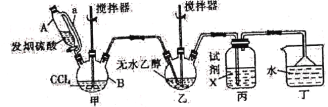
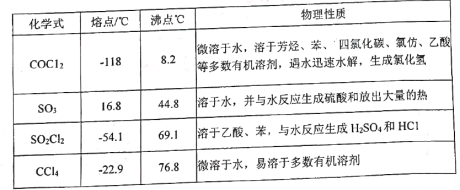
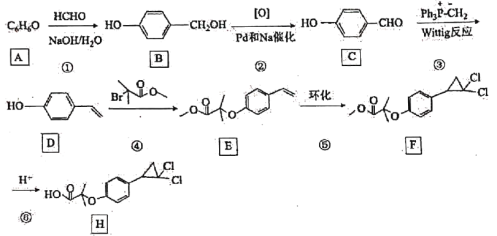
【题目】催化剂在现代化学工业中占有极其重要的地位,主要涉及过渡元素及其化合物、硅、铝化合物等。中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。
(1)硅、碳位于同一主族,用“>”“<”或“=”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 | ①Si__________C | ②C_________Si | ③CO2______SiO2 | ④H-Si_______H-C |
(2)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有_____________(任写一种);1mol[Fe(CN)6]3-中含____________mol σ键。
(3)已知:反应2CH4![]() CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
(4)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(5)基态F原子的价层电子排布图为___________。
(6)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为____________。
(7)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
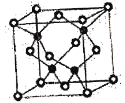
①CuF的熔点比CuCl的高,原因是____________________________________________。
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图所示,则CuF的晶胞参数a=__________nm(列出计算式)。
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)

物质 | 燃烧热/(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)
(3)在400℃时,向初始体积为1L的恒压密闭反应,器中充入1 mol CH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:

①在该温度下,其平衡常数KC=____________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率____________。(填“增大”“减小”“不变”或“无法确定”),理由是_______________________________。
③若反应器的体积固定,不同压强下可得变化如右图所示,则压强P1,P2的大小关系是____________。

(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式________________________________________________。
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。