题目内容
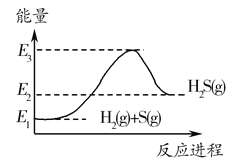
【题目】如图表示800℃时A、B、C三种气体的物质的量浓度随时间变化的情况,t时各组分浓度不再变化。试回答:

(1)该反应的反应物是_____,达平衡时其转化率是___。
(2)该反应的化学方程式是______。
(3)若t是2min,A物质的平均反应速率是______。
【答案】A 50% 3A![]() B+3C 0.6mol·L-1·min-1
B+3C 0.6mol·L-1·min-1
【解析】
在反应过程中减少的物质是反应物,增加的物质是生成物,根据物质浓度变化量的比等于化学方程式的计量数的比书写反应方程式,结合物质的转化率、化学反应速率的含义进行计算。
(1)由图可知,随着反应的进行,A的浓度降低,A为反应物,B、C的浓度增大, B、C为生成物;从开始到达到平衡时,A的浓度变化了△c(A)=2.4mol/L-1.2mol/L,则物质A的转化率=![]() ×100%==50%;
×100%==50%;
(2)由图可知,△c(A)=2.4mol/L-1.2mol/L=1.2mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为1.2mol/L:0.4mol/L:1.2mol/L=3:1:3,该反应进行到tmin后各种物质的浓度不再变化,说明反应为可逆反应,故反应方程式为3A![]() B+3C;
B+3C;
(3)由图可知在2min内,A物质的浓度变化量为△c(A)=2.4mol/L-1.2mol/L=1.2mol/L,,所v(A)=![]() =0.6mol·L-1·min-1。
=0.6mol·L-1·min-1。

【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH_________0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时υ正_____υ逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO(g)的浓度(mol·L-1)分别为0.2、0.1则:
①平衡时H2的转化率为________(保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________(填“增大”、“减小”或“不变”)