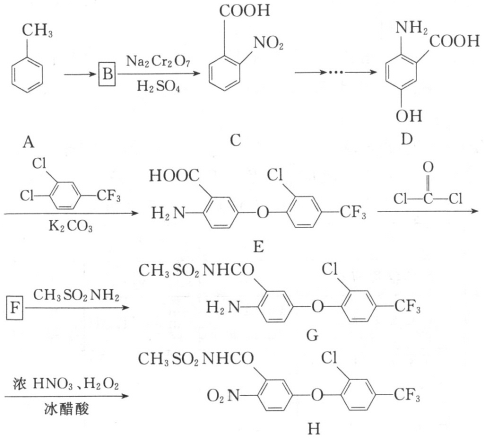
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
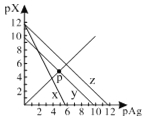
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012