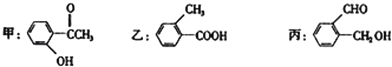
题目内容
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
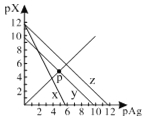
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
【答案】D
【解析】
A、根据图中曲线x的数据知pAg=-lgc(Ag+)=6,c(Ag+)=10-6mol/L,pX=-lg c(Xn-)=0,则c(Cl-)=1mol/L,Ksp(AgCl)= 10-6,与表中数据不符,选项A错误;
B、析出沉淀时,AgCl溶液中c(Ag+)=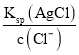 =
=![]() mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L,Ag2CrO4溶液中c(Ag+)=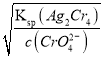 =
=![]() mol/L,c(Ag+)越小,先生成沉淀,则首先产生白色沉淀,选项B错误;
mol/L,c(Ag+)越小,先生成沉淀,则首先产生白色沉淀,选项B错误;
C、298K时若增大p点的阴离子浓度,由图可知,若沿曲线向上移动,c(Ag+)减小,选项C错误;
D、298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=
2AgSCN(s)+CrO42- (aq)的平衡常数K=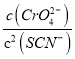 =
=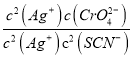 =
=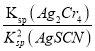 =
=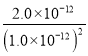 =2.0×1012,选项D正确。
=2.0×1012,选项D正确。
答案选D。

【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为