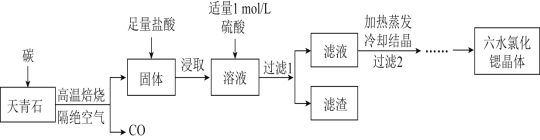
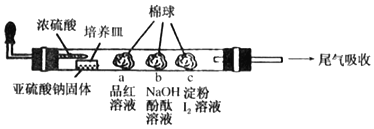
题目内容
【题目】(1)密闭容器中mA(g)+nB(g)![]() pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
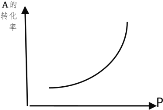
①增大压强,A的转化率___平衡向___移动,达到平衡后,混合物中C的浓度___。
②上述化学方程式中的系数m、n、p的正确关系是____。
③当降低温度时,C的浓度减小,正反应是___热反应。
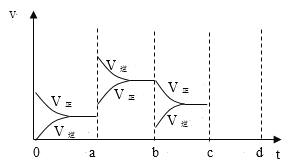
(2)如图表示在密闭容器中反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是____;若增大压强时,反应速度变化情况画在c-d处。___
2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是____;若增大压强时,反应速度变化情况画在c-d处。___
【答案】提高 右(正方向) 增大 m+n>p 吸 升温 减小SO3浓度 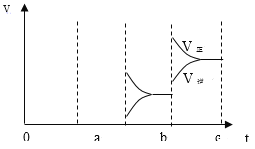
【解析】
根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;根据影响化学平衡移动的因素进行判断得出正确结论,升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动。
(1) ①由图象可以知道,增大压强,A的转化率升高,平衡正向移动,C的质量分数增大,
因此,本题正确答案是:提高;正向,增大;
②增大压强,平衡正向移动,故 m+n>p ;因此,本题正确答案是:故m+n>p ;
③当降低温度时,C的浓度减小,平衡逆向移动,A的转化率降低,正反应是吸热反应,
因此,本题答案是:吸
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为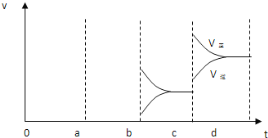 ,
,
因此,本题正确答案是:升高温度;减小SO3浓度;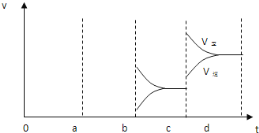 .
.