题目内容
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)ΔH=__kJ/mol。
CH3OH(g)+H2O(l)ΔH=__kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
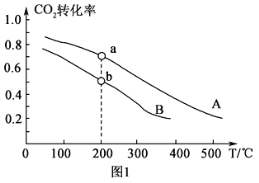
其中a点的平衡常数表达式为:__。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
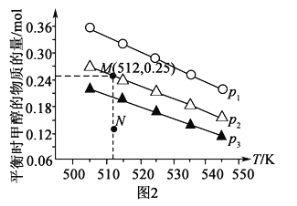
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___。
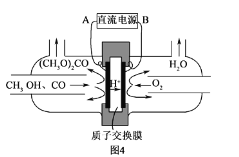
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__。
【答案】-94.3 K=![]() 大于 AC < >
大于 AC < > ![]() ×100% 2CH3OH+CO-2e-=(CH3O)2CO+2H+
×100% 2CH3OH+CO-2e-=(CH3O)2CO+2H+
【解析】
(1)由CO、H2、CH3OH(g)的燃烧热可得热化学方程式:①H2(g)+![]() O2(g)=H2O(l)△H1=-285.8kJmol-1,②CH3OH(g)+
O2(g)=H2O(l)△H1=-285.8kJmol-1,②CH3OH(g)+![]() O2(g)=CO2(g)+2 H2O(l)△H2=-725.8kJ/mol,③CH3OH(g)=CH3OH (l)△H3=-37.3 kJ/mol,由盖斯定律可知,3×①-②-③可得CO(g)+2H2(g)CH3OH(g),据此求算△H;
O2(g)=CO2(g)+2 H2O(l)△H2=-725.8kJ/mol,③CH3OH(g)=CH3OH (l)△H3=-37.3 kJ/mol,由盖斯定律可知,3×①-②-③可得CO(g)+2H2(g)CH3OH(g),据此求算△H;
(2)平衡常数K=![]() ;温度相同时,依据压强与二氧化碳的转化率关系判断A、B所在曲线的压强高低,结合温度多速率的影响判断Va与Vb;依据原子利用率=期望产物的总质量与生成物的总质量之比解答;
;温度相同时,依据压强与二氧化碳的转化率关系判断A、B所在曲线的压强高低,结合温度多速率的影响判断Va与Vb;依据原子利用率=期望产物的总质量与生成物的总质量之比解答;
(3)结合图象和影响平衡的因素分析;
(4)①由图象可知升高温度CO的转化率降低,说明平衡逆向移动;
②由图象可知升高温度CO的转化率降低,说明平衡逆向移动,则K减小;
(5)恒温恒容下,气体的压强之比等于其物质的量之比,计算平衡时气体的总物质的量,再利用差量法计算参加反应甲醇的物质的量,进而计算甲醇的转化率;
(6)阳极上甲醇失电子和CO反应生成碳酸二甲酯。
(1)由CO、H2、CH3OH(g)的燃烧热可得热化学方程式:①H2(g)+![]() O2(g)=H2O(l)△H1=-285.8kJmol-1,②CH3OH(g)+
O2(g)=H2O(l)△H1=-285.8kJmol-1,②CH3OH(g)+![]() O2(g)=CO2(g)+2 H2O(l)△H2=-725.8kJ/mol,③CH3OH(g)=CH3OH (l)△H3=-37.3 kJ/mol,由盖斯定律可知,3×①-②-③可得CO(g)+2H2(g)CH3OH(g),故△H=3×△H1-△H2-△H3=3×(-285.8kJ/mol )-(-725.8kJ/mol )-(-37.3kJ/mol )=-94.3kJ/mol;
O2(g)=CO2(g)+2 H2O(l)△H2=-725.8kJ/mol,③CH3OH(g)=CH3OH (l)△H3=-37.3 kJ/mol,由盖斯定律可知,3×①-②-③可得CO(g)+2H2(g)CH3OH(g),故△H=3×△H1-△H2-△H3=3×(-285.8kJ/mol )-(-725.8kJ/mol )-(-37.3kJ/mol )=-94.3kJ/mol;
(2)CO2(g)+3H2(g)CH3OH(g)+H2O(g)该反应的平衡常数表达式为:K=![]() ;温度相同时,增大压强,平衡向正反应方向移动,则CO2的转化率增大,所以曲线A所在点压强高为0.5MP,由于A点温度高与B点,所以Va大于Vb;
;温度相同时,增大压强,平衡向正反应方向移动,则CO2的转化率增大,所以曲线A所在点压强高为0.5MP,由于A点温度高与B点,所以Va大于Vb;
(3)A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,故B错误;
C.由图可知,M点对应的甲醇产量为0.25mol,则:

又体积为1.0L,所以K=![]() =
=![]() =1.04×10-2,故C正确;
=1.04×10-2,故C正确;
D.由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆)span>,故D错误;
故答案为:AC;
(4)①由图象可知升高温度CO的转化率降低,说明平衡逆向移动,逆反应吸热,正反应放热,△H<0;
②由图象可知升高温度CO的转化率降低,说明平衡逆向移动,则K减小,即K1>K2;
(5)设起始 n(H2O)=n(CH3OH)=1mol,恒温恒容下,气体的压强之比等于其物质的量之比,平衡时气体的总物质的量2mol×![]() ,
,

故甲醇的转化率为 ×100%=
×100%=![]() ×100%;
×100%;
(6)阳极上甲醇失电子和CO反应生成碳酸二甲酯,电极反应式为2CH3OH+CO-2e-═(CH3O)2CO+2H+。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案


