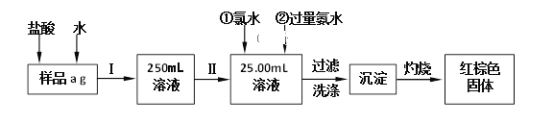
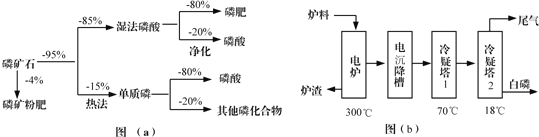
【题目】化学一选修:化学与技术磷矿石主要以[Ca3(PO4)2H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的____________;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:___________,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸___________t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是___________(填化学式),冷凝塔1的主要沉积物是___________,冷凝塔2的主要沉积物是___________。
(4)尾气中主要含有___________,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去___________;再通入次氯酸钠溶液,可除去___________(均填化学式)。
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是___________。
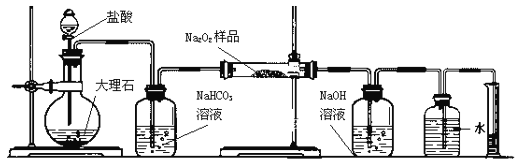
【题目】过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。
| |||||
A | B | C | D | E | F |
(1)写出装置A中两种主要玻璃仪器的名称__________、_______。
(2)写出装置A中发生的离子方程式____________________________。
(3)装置B的作用是______________________________。
(4)写出装置C中发生反应的主要化学方程式:______________________________。
(5)装置D中 NaOH的作用是________________________________________。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________
【题目】下图是某儿童微量元素体检报告单的部分数据,根据数据,回答下列问题:
北京市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ |
| 7.52~11.82 |
3 | 钙(Ca) | 1.68 |
| 1.55~2.10 |
(1)该儿童体内_________元素含量偏低。
(2)报告单中“μmol·L-1”是__________(填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________性。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是_______________________。
(5)取补血剂片用研钵研细,加入过量稀硫酸,取澄清液,然后滴加KSCN溶液,若溶液变为红色,则溶液中含有________(填离子符号),说明补血剂是否变质____________。
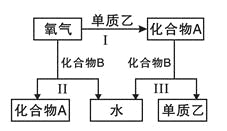
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
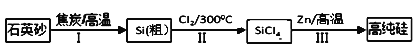
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。