题目内容
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下,其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________________。
(2)混合气体中碳原子的个数为______________(用NA表示阿伏加德罗常数的值)。
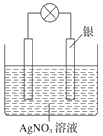
(3)将混合气体依次通过如图所示装置,剩余气体最后收集在气球中(实验在标准状况下测定)。
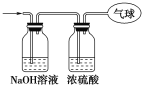
①气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
②气球的体积为________L。
【答案】36 g·mol-1 0.4NA 2.8NA 4.48
【解析】
设CO的物质的量为xmol;CO2的物质的量为ymol,则有28x+44y=14.4 22.4(x+y)=8.96,解得CO的物质的量为0.2mol;CO2的物质的量为0.2mol,以此解答。
(1)混合气体的体积为8.96L,则物质的量为其物质的量为:n=![]() =
=![]() =0.4mol,混合气体的平均摩尔质量为:
=0.4mol,混合气体的平均摩尔质量为:![]() =36g/mol,故答案为:36g/mol;
=36g/mol,故答案为:36g/mol;
(2)由分析可知CO的物质的量为0.2mol,CO2的物质的量为0.2mol,混合气体中碳原子的物质的量为0.2mol×1+0.2mol×1=0.4mol,个数为0.4 NA;
(3)①二氧化碳与氢氧化钠反应,气球中收集到一氧化碳,1个CO分子中含有14个电子,0.2molCO中电子总数为2.8NA;
②标准状况下0.2molCO体积为V=n×Vm=0.2mol×22.4L/mol=4.48L;

 优学名师名题系列答案
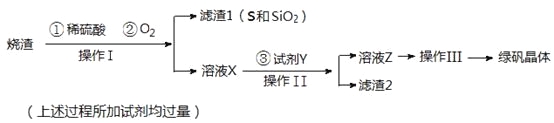
优学名师名题系列答案【题目】向如图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是 ( )
A | B | C | D | |
X | SO2 | H2S | CO2 | Cl2 |
Y | 饱和NaHCO3 | 浓硫酸 | Na2SO3 | NaHCO3 |
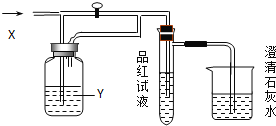
A.A正确B.B正确C.C正确D.D正确
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【题目】下图是某儿童微量元素体检报告单的部分数据,根据数据,回答下列问题:
北京市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ |
| 7.52~11.82 |
3 | 钙(Ca) | 1.68 |
| 1.55~2.10 |
(1)该儿童体内_________元素含量偏低。
(2)报告单中“μmol·L-1”是__________(填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________性。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是_______________________。
(5)取补血剂片用研钵研细,加入过量稀硫酸,取澄清液,然后滴加KSCN溶液,若溶液变为红色,则溶液中含有________(填离子符号),说明补血剂是否变质____________。