题目内容
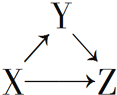
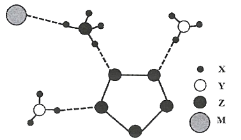
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系。根据要求回答问题:

(1)上图三个反应中,属于氧化还原反应的有____个。
(2)若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有____。
A.还原性:H2R>H2O B.酸性:H2R>H2O
C.稳定性:H2R<H2O D.沸点:H2R<H2O
(3)若化合物B常温下为气体,其水溶液呈碱性(答题必须用具体物质表示)。
①化合物B的电子式为______;其水溶液呈碱性的原因是______(用离子方程式表示)。
②化合物B可与O2组成燃料电池(氢氧化钾溶液为电解质溶液),其反应产物与反应Ⅲ相同。写出该电池负极的电极反应式______________________。
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,则反应Ⅰ的热化学方程式为______________(注:反应条件相同、所有物质均为气体)。
【答案】3 A、C ![]() NH3+H2O
NH3+H2O![]() NH4++OH— 2NH3-6e-+6OH-=N2+6H2O N2(g)+O2(g)=2NO(g) △H = 0.2(△H1-△H2)
NH4++OH— 2NH3-6e-+6OH-=N2+6H2O N2(g)+O2(g)=2NO(g) △H = 0.2(△H1-△H2)
【解析】
(1)有单质参加或生成的反应是氧化还原反应,据此判断;
(2)R与氧同主族,则在周期表中R在氧元素的下方,非金属性强弱的判据有单质的氧化性、离子的还原性、氢化物的稳定性、最高价氧化物的水化物的酸性等;
(3)B的水溶液呈碱性,则B为NH3。反应Ⅱ为5O2+4NH3=4NO+6H2O,则A为NO,反应Ⅲ为6NO+4NH3=5N2+6H2O,单质乙为N2。根据原电池的工作原理写出电极反应式,根据盖斯定律写出反应Ⅰ:N2+O2=2NO的热化学方程式。
(1)有单质参加或生成的化学反应属于氧化还原反应,则右图三个反应中,属于氧化还原反应的有3个。
(2)氢化物的稳定性和还原性,最高价含氧酸的酸性、单质的氧化性的相对强弱,都能用来比较相应元素的非金属性的相对强,A.还原性:H2R>H2O,所以单质的氧化性:O2>R,则能说明非金属性R<O;B.最高价含氧酸的酸性强弱可以判断非金属性的强弱,不是气态氢化物的酸性强弱,不能比较;C.非金属性越强,气态氢化物越稳定,则热稳定性:H2R<H2O,能比较;D.沸点:H2R<H2O,是因水中存在氢键,沸点高,不能比较非金属性;选AC。
(3)①化合物B常温下为气体,其水溶液呈碱性,说明B是氨气,则氨气的电子式为:![]() ,NH3·H2O是一元弱碱,电离方程式为:NH3+H2O
,NH3·H2O是一元弱碱,电离方程式为:NH3+H2O![]() NH4++OH—;
NH4++OH—;
② 在氨气、氧气燃料电池中,氨气失电子做负极,在碱性环境中生成氮气和水,则该电池负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O;
③根据如图所示转化关系,反应Ⅰ为N2(g)+O2(g)=2NO(g) △H ,反应Ⅱ为5O2(g)+4NH3(g)=4NO(g)+6H2O(g) △H1,反应Ⅲ为6NO(g)+4NH3(g)=5N2(g)+6H2O(g) △H2,根据盖斯定律,反应Ⅰ的热化学方程式为 N2(g)+O2(g)=2NO(g) △H = 0.2(△H1-△H2)。

【题目】过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。
| |||||
A | B | C | D | E | F |
(1)写出装置A中两种主要玻璃仪器的名称__________、_______。
(2)写出装置A中发生的离子方程式____________________________。
(3)装置B的作用是______________________________。
(4)写出装置C中发生反应的主要化学方程式:______________________________。
(5)装置D中 NaOH的作用是________________________________________。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________