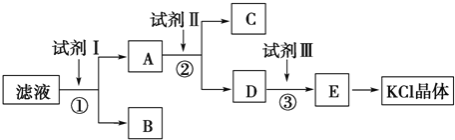
【题目】X、Y、Z、W是元素周期表中的短周期元素,它们的相对位置如下表所示,其中X、Y 元素均能形成10电子的氢化物,Z的原子序数是Y的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)W的简单离子的结构示意图为______,Y元素在周期表中的位置是____。
(2)写出实验室制W元素单质的离子方程式:___________
(3)关于W同主族元素,下列说法正确的是:__________
A.从上到下密度逐渐增大
B.从上到下熔点和沸点都逐渐升高
C.从上到下元素的非金属性越来越强
D.同主族元素对应的单质中,只有W元素对应的单质在常态下为气态
(4)W与Z形成的液体化合物Z2W2,该物质可与水反应生成ZO2气体,1 mol Z2W2参加反应时转移1.5 mol电子,其中只有一种元素化合价发生改变,Z2W2与水反应的化学方程式为_____。
【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是_______。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是______。
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种灰绿色氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入________,再往试管中加入_________,振荡,现象与实验1相同,结论是该假设不成立。
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10mLNaOH溶液 | 滴加FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/LNaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/LNaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是__________,证明该假设成立。
(3)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件_____。
(4)下列情况会导致所配NaOH溶液的浓度偏高的是_______。
A.NaOH溶液未冷却至室温就进行定容 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出