题目内容
【题目】KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,某同学先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作
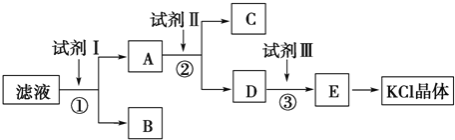
(1)试剂Ⅰ的化学式为__________,其作用是除去__________(填离子符号),
检验该离子完全除尽的操作是__________________________________________
(2)加入试剂Ⅱ时发生反应的化学方程式为_____________________________
(3)试剂Ⅲ的名称是__________,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用__________(填字母).
A.AgNO3 B.pH试纸 C.K2CO3溶液
【答案】BaCl2或Ba(OH)2 SO42- 静置,取少量上层澄清溶液于试管中,再滴加BaCl2 或Ba(OH)2溶液,若无白色沉淀产生在,则原溶液中SO42- 完全除尽;反之,则未除尽 BaCl2 + K2CO3 = BaCO3↓+ 2KCl (或Ba(OH)2+K2CO3=2KOH+BaCO3↓) 盐酸 B
【解析】
KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,除去不溶于水的杂质,滤液中含有可溶性的杂质KOH、K2SO4,由流程可知,滤液中加试剂I为足量的BaCl2或Ba(OH)2,生成硫酸钡沉淀,除去硫酸根离子,操作①为过滤,分离出B为BaSO4,滤液A含BaCl2(或Ba(OH)2)、KOH、KCl,加试剂II为K2CO3,除去过量的钡离子,操作②为过滤,分离出C为BaCO3,D中含KCl、KOH、K2CO3,试剂III为盐酸,再加适量盐酸,③中发生K2CO3+2HCl=2KCl+H2O+CO2↑,KOH+HCl=KCl+H2O,得到E为KCl溶液,再蒸发结晶得到KCl晶体,据此解答。
KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,除去不溶于水的杂质,滤液中含有可溶性的杂质KOH、K2SO4,由流程可知,滤液中加试剂I为足量的BaCl2或Ba(OH)2,生成硫酸钡沉淀,除去硫酸根离子,操作①为过滤,分离出B为BaSO4,滤液A含BaCl2(或Ba(OH)2)、KOH、KCl,加试剂II为K2CO3,除去过量的钡离子,操作②为过滤,分离出C为BaCO3,D中含KCl、KOH、K2CO3,试剂III为盐酸,再加适量盐酸,③中发生K2CO3+2HCl=2KCl+H2O+CO2↑,KOH+HCl=KCl+H2O,得到E为KCl溶液,再蒸发结晶得到KCl晶体,
(1)由以上分析知,试剂Ⅰ的化学式为BaCl2或Ba(OH)2,其作用是除去SO42-,检验该离子完全除尽的操作是静置,取少量上层澄清溶液于试管中,再滴加BaCl2或Ba(OH)2溶液,若无白色沉淀产生在,则原溶液中SO42- 完全除尽,反之,则未除尽;
故答案为:BaCl2或Ba(OH)2;SO42-;静置,取少量上层澄清溶液于试管中,再滴加BaCl2或Ba(OH)2溶液,若无白色沉淀产生在,则原溶液中SO42- 完全除尽,反之,则未除尽;
(2)试剂II为K2CO3,除去过量的钡离子,则加入试剂Ⅱ时发生反应的化学方程式为BaCl2 + K2CO3 = BaCO3↓+ 2KCl或Ba(OH)2+K2CO3=2KOH+BaCO3↓;
故答案为:BaCl2 + K2CO3 = BaCO3↓+ 2KCl或Ba(OH)2+K2CO3=2KOH+BaCO3↓;
(3)试剂Ⅲ的名称是盐酸,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用pH试纸,而加硝酸银、碳酸钾会引入新杂质,不宜检验是否过量,
故答案为:盐酸;B。