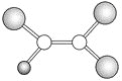
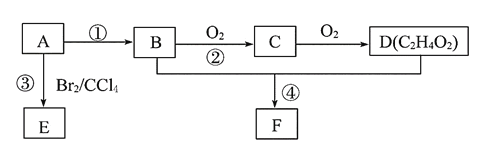
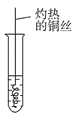
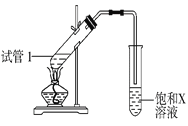
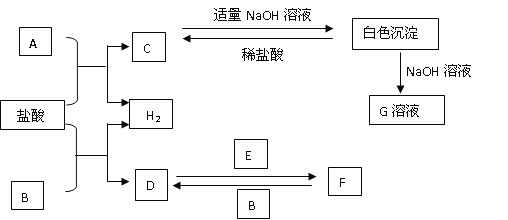
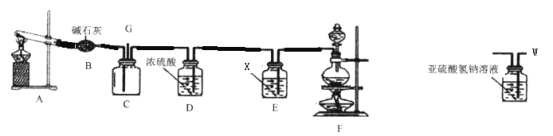
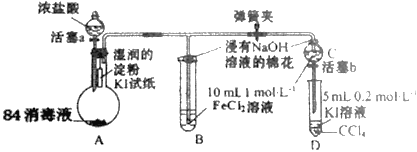
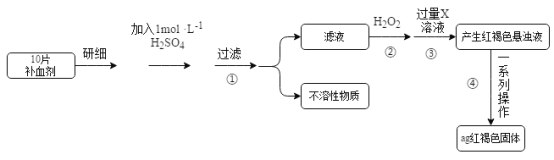
0 197704 197712 197718 197722 197728 197730 197734 197740 197742 197748 197754 197758 197760 197764 197770 197772 197778 197782 197784 197788 197790 197794 197796 197798 197799 197800 197802 197803 197804 197806 197808 197812 197814 197818 197820 197824 197830 197832 197838 197842 197844 197848 197854 197860 197862 197868 197872 197874 197880 197884 197890 197898 203614