题目内容
【题目】铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法不正确的是( )
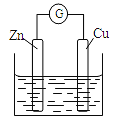
A. 锌电极上的反应为Zn-2e-=Zn2+
B. 溶液中的硫酸根向锌电极移动
C. 铜电极质量增加
D. 电流从锌电极经过金属导线流向铜电极
【答案】D
【解析】
A. 铜-锌原电池中锌是负极,锌电极上的反应为Zn-2e-=Zn2+,故A正确;
B. 铜-锌原电池中锌是负极,原电池中阴离子向负极移动,溶液中的硫酸根向锌电极移动,故B正确;
C. 铜-锌原电池中铜电极是正极,电解质溶液为硫酸铜溶液,电极反应式是Cu2++2e-=Cu,铜电极质量增加,故C正确;
D. 铜-锌原电池中锌是负极,原电池中电流由正极流向负极,电流从铜电极经过金属导线流向锌电极,故D错误;
答案选D。

【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
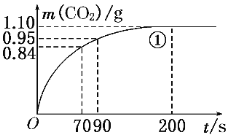
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。