题目内容
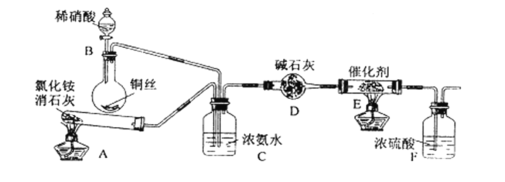
【题目】某同学利用如下实验装置验证用蘸有浓氨水的棉签检验运送氯气的管道是否有氯气泄漏(已知:8NH3+3Cl2=N2+6NH4Cl)。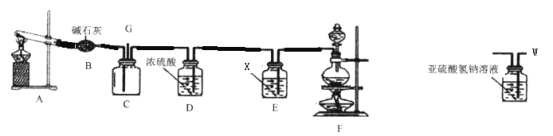
回答下列问题:
(1)写出A装置中反应的化学方程式________;
(2)试剂X为__________;
(3)写出装置F制取氯气的离子方程式为________;
(4)装置B的作用是_______,装置C中的现象是__________;
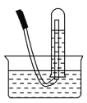
(5)G端连接上图装置W的作用是__________。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 饱和食盐水(或饱和NaCl溶液) MnO2+4H++2Cl-
CaCl2+2NH3↑+2H2O 饱和食盐水(或饱和NaCl溶液) MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 干燥氨气 有白烟生成 吸收剩余的氨气和氯气、防止污染环境
Mn2++Cl2↑+2H2O 干燥氨气 有白烟生成 吸收剩余的氨气和氯气、防止污染环境
【解析】
装置A制备氨气、装置B干燥氨气;装置F制备氯气、装置E除氯气中的氯化氢、装置D干燥氯气、装置C中氯气与氨气反应生成氯化铵和氮气。
(1)装置A用氯化铵和氢氧化钙加热制备氨气,反应的化学方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)装置E除氯气中的氯化氢,所以试剂X为饱和食盐水;
(3)装置F是用二氧化锰与浓盐酸加热制备氯气,制取氯气的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)装置B是用碱石灰干燥氨气,装置C中氯气与氨气反应生成氯化铵和氮气,现象是有白烟生成;
(5)图装置W中的亚硫酸氢钠可以吸收氨气和氯气,所以G端连接上图装置W的作用是吸收剩余的氨气和氯气、防止污染环境。

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目