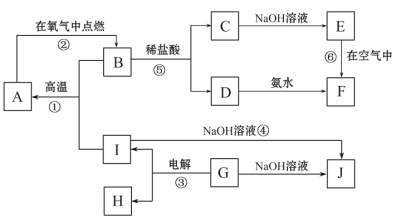
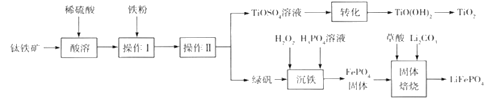
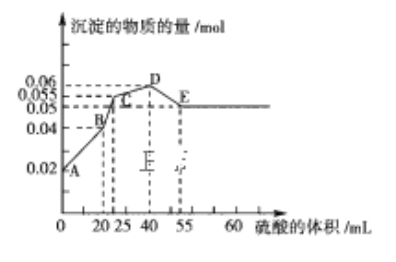
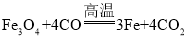【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
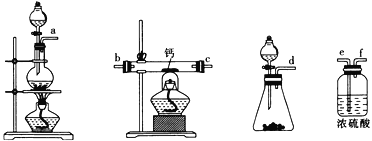
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。
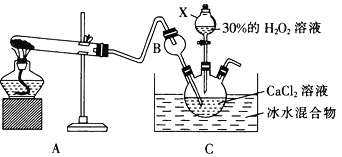
①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
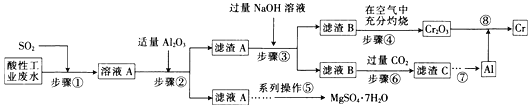
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
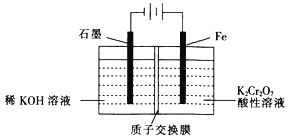
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。