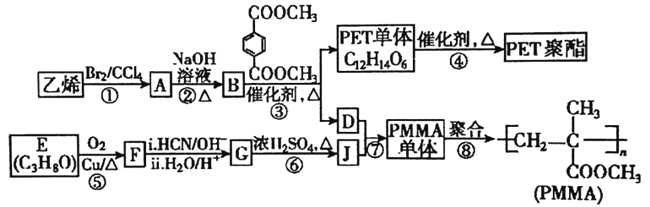
题目内容
【题目】铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为___________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是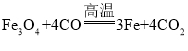 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
【答案】O2 +4e-+2H2O=4OH- 2Fe3++Cu=Cu2++2Fe2+ Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体 12mol
Fe(OH)3(胶体)+3H+ Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体 12mol
【解析】
(1)吸氧腐蚀时,正极O2得电子生成4OH-;
(2)FeCl3溶液与Cu反应生成CuCl2与FeCl2;
(3)Fe3+水解显酸性,据此分析作答;
(4)依据氧化还原反应的规律作答。
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2 +4e-+2H2O=4OH-;
(2)根据氧化剂的氧化性大于氧化产物的氧化性规律可知,FeCl3与铜板反应的离子方程式为:2Fe3++Cu=Cu2++2Fe2+;
(3)Fe3+水解生成的Fe(OH)3胶体具有净水作用,原理方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,硫酸铁中由于Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去;
Fe(OH)3(胶体)+3H+,硫酸铁中由于Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去;
(4)氧化还原反应 中,1mol Fe3O4参加反应,转移电子的物质的量是8mol,所以有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol。
中,1mol Fe3O4参加反应,转移电子的物质的量是8mol,所以有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案