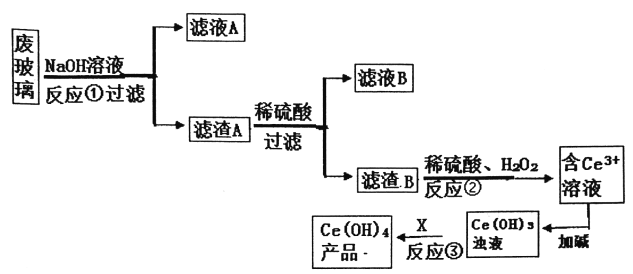
题目内容
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
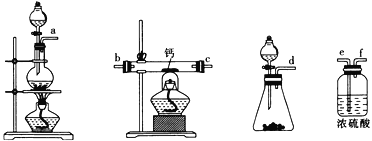
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。
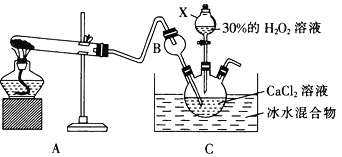
①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
【答案】(1)①2CaO2+4HCl=2CaCl2+2H2O+O2↑②H2O2(2)①d→e→f→b→c→e(或d→e→f→c→b→e)
②熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞。
(3)①中和生成的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2·8H2O的溶解,或提高产品的产率等,其他合理答案)②烧杯、漏斗、玻璃棒;沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次。(4)在FeCl3溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强。
【解析】
试题(1)① CaO2与盐酸反应产生CaCl2、H2O和氧气,反应的化学方程式为2CaO2+ 4HCl= 2CaCl2+ 2H2O+O2↑;②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2;该物质具有氧化性,将红色的物质氧化变为无色;(2)用H2O2与MnO2反应产生O2,用浓硫酸干燥,氧气,燃烧是氧气与Ca在加热时发生反应产生CaO2,为防止空气中的水份影响反应产物,应该再通过盛有浓硫酸的洗气瓶。故装置的连接顺序是d→e→f→b→c→e(或d→e→f→c→b→e);②根据完整的实验装置进行实验,实验步骤如下:I.检验装置的气密性后,装入药品;II.打开分液漏斗活塞,通入气体一段时间,加热药品;III反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;IV拆除装置,取出产物。①根据反应方程式可知NH3与反应产生的H+结合形成NH4+,所以在Ca2+和 H2O2 的反应过程中所起的作用是中和生成的氢离子,促进反应进行;②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次;(4)证明CaO2的氧化性比FeCl3的氧化性强实验是在FeCl3溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强。

【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 将纯碱和硫酸反应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
C |
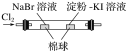
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D |
| 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D